Regra geral para caracterização de estenoses:
- Na mesma artéria ou artérias contíguas: dobrar velocidade
- Em artérias com emergência terminolateral: triplicar a velocidade
- Em veias: triplicar a velocidade
CARÓTIDAS E VERTEBRAIS
INDICAÇÕES DO EXAME:
- Investigação de causa embólica para acidentes vasculares encefálicos (AVEs) ou ataques isquêmicos transitórios (AITs);
- Investigação de etiologia vascular para sintomas neurológicos atípicos ou não-focais;
- Controle pós-endarterectomia ou stent carotídeo;
- Pré-operatório de pacientes arteriopatas graves;
- Massas cervicais pulsáteis;
- Trauma ou dissecção;
- Rastreamento de doença aterosclerótica carotídea e vertebral.
TÉCNICA DO EXAME:

Imagem de US com modo B de uma bifurcação carotídea normal. ACIE: artéria carótida interna calibrosa e sem ramos; ACEE: artéria carótida externa esquerda de menor calibre e com ramos.
Paciente na posição supina ou semi-supina, com a cabeça discretamente hiperestendida e rodada 45° para o lado contrário ao avaliado.
Idealmente, é utilizado transdutor linear de alta frequência (> 7MHz). O uso de transdutores convexos pode ser necessário em pacientes com pescoço “curto”, com limitações à movimentação do pescoço ou em bifurcações carotídeas altas.
Segmentos arteriais avaliados: artérias carótidas comuns (ACCs), carótidas externas (ACEs), segmento cervical das carótidas internas (ACIs) e segmentos V1 (extraósseo) e V2 (foraminal) das vertebrais (AVs).
O principal objetivo do exame é pesquisar por placas de ateromatose e avaliar se causam estenose hemodinamicamente sgnificativas. Além disso, deve-se medir o complexo mediointimal e investigar outras eventuais patologias, tais como: dissecções, (pseudo)aneurismas, roubo da subclávia (inversão do sentido do fluxo na artéria vertebral) e estenoses funcionais (por acotovelamento no trajeto do vaso, por exemplo).
Modo B:
- Avaliação das carótidas comuns, bulbos, carótidas internas e externas, pesquisando placas e estenoses. Caso haja placas, observar se têm características de instabilidade, como ulcerações, fluxo interno ou não ser calcificada (placa “mole”).
- Medir a espessura do complexo mediointimal das artérias carótidas comuns, que representa a distância entre as interfaces lúmen-intimal e media-adventícia.
Doppler:
- ACCs: seguir todo o seu trajeto com o Doppler colorido ligado, pois algumas placas não calcificadas muitas vezes não são observadas somente pelo modo B, e áreas parietais onde não ha fluxo (pelo formato do colorido) podem ser sinal de placa. Medir velocidade sistólica e diastólica final no terço distal e, quando houver placas, medir nas regiões antes e após as placas.
- ACEs: importante identificá-las (resistência alta, ramos, costuma ser medial à ACI) e medir o pico de velocidade sistólica (não precisa diastólica). Caso haja alguma placa mais importante, pode-se avaliar velocidade pré e pós placa para ver se determinar estenose significativa.
- ACIs: medir pico de velocidade sistólica e diastólica em sua emergência e pré e pós eventuais placas.
- AVs: observar sentido do fluxo e pico de velocidade sistólica. Tentar avaliá-la em toda sua extensão acessível.

Imagens de US Doppler de uma bifurcação carotídea normal com uso do Doppler colorido (esquerda) e do Doppler de Amplitude (direita). O Doppler de Amplitude é um tipo de Doppler colorido mais sensível a fluxos de baixa velocidade.

US Doppler de uma bifurcação carotídea normal. À esquerda, está demonstrado simultaneamente imagem acima com Doppler colorido e abaixo a curva espectral referente à amostra selecionada do box (neste caso da artéria carótida interna esquerda). À direita, exemplos de curvas espectrais normais nas artérias carótidas comum, externa e interna. Observe que o fluxo normal na carótida interna tem padrão de resistência baixo em relação ao de alta resistência verificado na carótida externa (este é um dos parâmetros utilizados para diferenciá-las ao Doppler).
INTERPRETAÇÃO DOS RESULTADOS:
– Espessura do complexo mediointimal. Trata-se de um índice mensurável do grau de ateromatose, que apresenta correlação com o risco de acidente vascular encefálico e infarto agudo do miocárdio. Considerado alterado quando maior ou igual a 1,0 mm;
– Localização, extensão e características das placas. Placas heterogêneas, ulceradas e/ou com fluxo interno ao Doppler colorido estão relacionadas a um risco mais elevado de AVE embólico. Placas homogêneas (fibrosas ou calcificadas) e com contornos lisos são consideradas mais estáveis;
– Pesquisa de oclusões ou estenoses hemodinamicamente significativas. A presença de estenoses hemodinamicamente significativas é verificada através da medida das velocidades com o Doppler pulsado, utilizando valores de referência disponíveis na literatura. Para a avaliação do grau de estenose na emergência das ACIs, são utilizadas as velocidades nos terços médios / distais das ACCs e na porção proximal das ACIs, além da avaliação subjetiva do grau de estreitamento luminal determinado pela placa.
Quando o objetivo é a avaliação de eventual repercussão hemodinâmica de uma placa situada em outra localização, são aferidas as velocidades antes e após a placa; um aumento maior ou igual a 2 vezes na velocidade de pico sistólico (VPS), caracteriza estenose hemodinamicamente significativa.
Alterações no trajeto das carótidas, como acotovelamentos, podem determinar estenoses funcionais, que são avaliadas quanto a eventual repercussão hemodinâmica através dos mesmos critérios mencionados.

Grant EG, Benson CB, Moneta GL, et al. Carotid artery stenosis: grayscale and Doppler US diagnosis Society of Radiologists in Ultrasound Consensus Conference. Ultrasound Q 2003;19(4): 190–198.

Estenose na emergência da artéria carótida interna direita (ACID). Pelo modo B (esquerda) observa-se placa endoluminal e, pelo seu aspecto, é possível suspeitar que determine estenose hemodinamicamente significativa. Ao Doppler colorido (centro) observa-se aumento focal de velocidade e turbilhonamento do fluxo (aliasing) na região da placa, o que aumenta a suspeição para estenose significativa. A confirmação da estenose hemodinamicamente significativa é possível através do Doppler espectral (direita), que evidencia velocidade de pico sistólico (VPS) de 201,1 cm/s e velocidade diastólica final de 54,1 cm/s, caracterizando estenose entre 50-69%.
Cabe ressaltar que, para a avaliação de estenoses em stents, são utilizados critérios distintos:

Critérios para definição de estenose em endopróteses nas artérias carótidas. Zhou W, Felkai DD, Evans M, et al. Ultrasound criteria for severe in-stent restenosis fllowing carotid artery stenting. J Vasc Surg 2008; 47:74-80. 23). Lal BK, Hobson RW 2nd, Tofighi B, et al. Duplex ultrasound velocity criteria for the stented carotid artery. J Vasc Surg 2008;47:63-73.
Velocidade nas artérias vertebrais costuma ser < 60 cm/s. Quando há síndrome do roubo da subclávia, por exemplo, pode haver aumento
compensatório na intensidade do fluxo na vertebral contralateral.
Os critérios utilizados para as artérias carótidas nativas SUPERESTIMAM o grau de estenose em artérias com stent.
DICAS E OBSERVAÇÕES:
- Se o fluxo for visualmente filiforme (sinal do barbante), mesmo com velocidades normais, considerar que pode haver estenose acentuada / critica.
- Na avaliação das velocidades nos segmentos carotídeos, o mais importante são os valores absolutos de VPS, que devem ser mais valorizados do que a relação entre os VPS da interna / comum. Uma exceção à esta regra ocorre quando a velocidade da artéria carótida comum é muito baixa (< 40-50 cm/s) ou muito alta (>125 cm/s, que caracterizaria estenose > 50%); nestes casos, preferir o uso da relação VPS da carótida interna / VPS da carótida comum.
- Quando há uma placa muito extensa, medir as velocidades pré e pós somente no ponto focal de estenose (um ponto de estenose mais acentuada dentro de uma placa). Já se for uma placa não tão extensa (conferir no consenso, pois existe um valor abaixo do qual se aplica isto), considerar as velocidades antes da placa (como um todo) e depois do ponto de estenose mais acentuada.
- Sempre considerar na avaliação, quando houver dúvida se há ou não estenose, o aspecto ao modo B do ponto de estreitamento. Posicionar o transdutor em um corte transversal neste local para avaliar subjetivamente o percentual de redução da área de secção transversal do vaso, e avaliar também em corte longitudinal. Se tiver um aspecto de estenose já ao modo B, suspeitar de estenose significativa.
- Quando há placas calcificadas que não permitem a visibilização de algum segmento devido a sombra acústica posterior:
- Se a sombra acústica posterior tiver extensão menor do que 1 cm e
- não houver fluxo turbulento após a placa, provavelmente não há estenose significativa (<50%) no segmento obscurecido pela sombra acústica posterior;
- e houver fluxo turbulento distalmente à placa, deve-se suspeitar de estenose significativa no segmento obscurecido pela sombra acústica posterior, e um outro método de imagem deve ser sugerido para complementar a avaliação e investigar estenose neste ponto (angioTC ou angioRM).
- Se a sombra acústica posterior tiver extensão maior que 2 cm, o grau de estenose é indeterminado (não é possível definir pelo US Doppler) e outras modalidades de imagem são recomendadas (angioTC ou angioRM).
- Se a sombra acústica posterior tiver extensão menor do que 1 cm e
- No caso de tortuosidade acentuada das artérias:
- Preferir o termo “acotovelamento” a “kinking”, pois acotovelamento é um termo mais geral, que inclui todo tipo de tortuosidade com ângulo maior que 90%.
- Raramente os acotovelamentos causam repercussão hemodinâmica, já que eles se formam lentamente, muitas vezes por redução da altura dos discos intervertebrais e alongamento das artérias. Normalmente quando há repercussão, são observadas placas ateromatosas associadas.
- Caso haja aumento de velocidade no acotovelamento, medir antes e depois para avaliar se há aumento maior que 2x da velocidade. Não medir na curva, pois a angulação da curvatura do acotovelamento causará erro de medição. Caso a velocidade dobre (2x) pode ser descrito como: “acotovelamento que causa estenose funcional hemodinamicamente significativa” ou “acotovelamento causando estenose funcional maior que 50% da artéria…”
AORTA E VEIA CAVA INFERIOR
INDICAÇÕES DO EXAME:
- Diagnóstico e acompanhamento de aneurismas e pseudoaneurismas da aorta abdominal (AAA) e artérias ilíacas;
- Avaliação pós-operatória de correção endovascular ou aberta de aneurismas;
- Avaliação da doença aterosclerótica;
- Dissecção;
- Arterites.
TÉCNICA DO EXAME:
A avaliação é realizada na posição supina utilizando transdutor linear ou convexo com faixas de frequências baixas, entre 2,5 e 5 MHz. Preferencialmente, o estudo deve ser precedido de jejum, para redução da interferência do excesso de gás intestinal e da peristalse exacerbada que ocorrem no estado pós-prandial.
Modo B:
- Calibre e trajeto da aorta abdominal e das artérias ilíacas comuns, internas e externas; os diâmetros anteroposterior e transverso são aferidos entre as paredes externas dos vasos. Preferivelmente, utiliza-se o diâmetro anteroposterior, uma vez que o transverso apresenta grande variabilidade;
- Identificação e caracterização de placas de ateromatose.
Doppler:
- Caracterização do fluxo (laminar ou turbulento) e medida do pico de velocidade sistólico e da velocidade diastólica final. Caso haja placas suspeitas para estenose, as velocidades pré e pós estreitamento são obtidas para determinar se há repercussão hemodinâmica significativa.
Técnica para avaliação de Aneurismas:
A ultrassonografia é um bom método para detecção de aneurismas da aorta abdominal, com acurácia diagnóstica próxima de 100%, podendo ser utilizada também para seguimento. Suas principais características analisadas à US Doppler são: morfologia, extensão longitudinal, maior diâmetro, calibre na região do colo e sua relação com a emergência das artérias renais; a caracterização de trombos parietais e a análise do padrão de fluxo ao Doppler no interior do aneurisma também são realizadas.
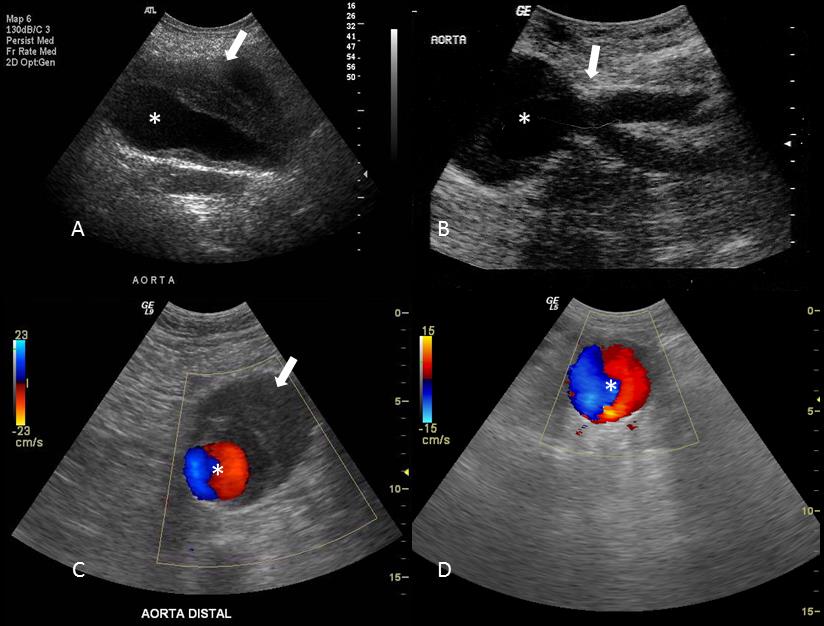
US Doppler demonstrando aneurisma da aorta infrarrenal. O aneurisma demonstrado ao modo B (A e B) e com Doppler colorido (C e D), notando-se o lúmen anecogênico pérvio (*) circundado por trombo mais ecogênico aderido às suas paredes (setas em A e C). Apresenta extensão até a transição aortoilíaca (seta em B).
Técnica para avaliação pós-operatória de correção endovascular de aneurismas:
A avaliação engloba a determinação das velocidades antes, no interior e após a endoprótese para pesquisa de estenoses, além da pesquisa da persistência de fluxo no saco aneurismático (endoleak). Apesar de a tomografia computadorizada ser o método de escolha para esta avaliação, a US Doppler vem sendo empregada com considerável sucesso, o que pode ser exemplificado pelo estudo de Sato et al., que demonstrou sensibilidade de 97% e especificidade de 74% para detecção de endoleak.

Avaliação pós-operatória com US Doppler de endoprótese para correção de aneurisma da aorta abdominal. Ao modo B (A e B), observa-se a endoprótese no interior do saco aneurismático, caracterizado por formação ecogênica com formato circular na imagem axial (A) e cilíndrico na imagem adquirida no eixo longitudinal da aorta (B). Através do Doppler colorido (C e D), é possível verificar a presença de fluxo no interior da endoprótese e ausência ao seu redor, indicando que o restante do lúmen está trombosado e não se observam endoleaks.
INTERPRETAÇÃO DE RESULTADOS:
– Aneurismas:
De forma geral, caracteriza-se aneurisma quando há aumento do calibre vascular mais do que 50% em relação a seu diâmetro presumido. O diâmetro normal da aorta varia de acordo com a idade e sexo. Em geral, um diâmetro maior do que 3,0 cm define AAA (aneurisma da aorta abdominal).
Cerca de 90-95% dos AAA situam-se no segmento infrarrenal e na maioria das vezes são verdadeiros e fusiformes. A prevalência de AAA aumenta com a idade, afetando cerca de 6% dos indivíduos com mais de 65 anos, com predomínio no sexo masculino. Apresenta etiologia multifatorial, incluindo aterosclerose, fatores genéticos, trauma, infecção, inflamação, tabagismo, doenças do tecido conectivo e alterações degenerativas.
Os parâmetros dos AAA avaliados à US Doppler influenciam na decisão e planejamento do tratamento adequado, além de apresentarem relação com o prognóstico. O risco de ruptura em pacientes do sexo masculino com AAA entre 5,0 e 5,9 cm é de aproximadamente 1% ao ano e, quando maior ou igual a 6 cm, é de 14,1 %. Em mulheres, o risco é 4x maior em relação a AAA de mesmo tamanho em homens. Além do tamanho, uma taxa anual de crescimento acima de 5,5-6 mm também indica risco alto de ruptura.
Alguns sinais indicativos da iminência de ruptura são observados somente em estudos de tomografia computadorizada, a qual constitui o exame de escolha para este propósito.
A presença de coleção fluida hipoecogênica retroperitoneal junto a um aneurisma deve levantar a suspeita de ruptura.
Pseudoaneurismas da aorta são mais frequentemente pós-traumáticos ou micóticos. Um aneurisma micótico é todo aquele que se torna infectado. Aneurismas micóticos e inflamatórios são tipos de aneurismas que podem ter achados distintos dos demais. A presença de gás intramural pode ser sinal de um aneurisma micótico. Aneurismas inflamatórios são mais comuns nas artérias ilíacas do que na aorta e podem ocorrer no contexto de fibrose retroperitoneal; à ultrassonografia, apresentam paredes espessas circundadas por tecido fibrótico hipoecogênico.
– Avaliação pós-operatória de correção endovascular de aneurismas:
Os dois principais focos de interesse são a pesquisa de endoleak e a avaliação de crescimento do saco aneurismático, ambos relacionados entre si. O endoleak ocorre em cerca de 10 a 25% dos casos e apresenta resolução espontânea em 40-50% das vezes. Alguns casos estão associados a aumento da pressão no saco aneurismático e risco aumentado de ruptura. Uma das classificações utilizadas é a de White modificada, que categoriza o endoleak em 5 tipos:
- Tipo I: fluxo através das extremidades de ancoragem da prótese. Pode ser subdividida em proximal (IA) e distal (IB). São comuns após correção de aneurismas da aorta torácica e em pacientes com anatomia difícil. Em geral, têm prognóstico reservado e o tratamento é mandatório, sobretudo no tipo IA;
- Tipo II: fluxo retrógrado para o saco aneurismático a partir de ramos da aorta, como artérias lombares, artéria mesentérica inferior ou artérias renais acessórias. É o tipo mais comum encontrado em correção de AAA e boa parte tem resolução espontânea;
- Tipo III: fluxo através de falhas na estrutura da prótese, como fraturas, orifícios ou separação dos componentes de próteses modulares. Em geral, necessita de tratamento;
- Tipo IV: fluxo através de porosidades da endoprótese (parte intencional do design da prótese). Não necessita de intervenção e seu diagnóstico é feito após exclusão dos demais tipos;
- Tipo V: quando há aumento das dimensões do saco aneurismático sem a identificação de fluxo; é também denominado de endotensão.
Estenoses da endoprótese também podem ocorrer e os critérios para sua caracterização são semelhantes aos usados para artéria periféricas com endopróteses.
– Dissecção:
Ocorre quando um defeito na parede arterial permite a entrada de sangue, determinando separação entre as camadas íntima e média, criando um falso lúmen. A dissecção se estende por segmento de tamanho variável e geralmente termina com a reentrada da coluna de sangue para o lúmen verdadeiro através de um segundo defeito intimal; isto descomprime o hematoma e atrasa uma eventual ruptura. A maior parte das dissecções da aorta tem origem em seu segmento torácico, sobretudo no ascendente. Quando na aorta abdominal, quase sempre representa extensão de dissecção da aorta torácica, raramente ocorrendo isoladamente no segmento abdominal na ausência de trauma. As classificações de Stanford e de DeBakey são as mais utilizadas:
| CLASSIFICAÇÃO DE STANFORD |
| – Tipo A (60%): Envolve a aorta ascendente; pode ou não apresentar extensão para a aorta descendente |
| – Tipo B (40%): Limitada à aorta descendente |
| CLASSIFICAÇÃO DE DEBAKEY |
| – Tipo I: Envolve a aorta ascendente, o arco aórtico e a aorta descendente |
| – Tipo II: Limitada a aorta ascendente |
| – Tipo III: Envolve a aorta descendente distalmente à emergência da artéria subclávia esquerda |
O método de escolha para avaliação de dissecção aórtica é a tomografia computadorizada, no entanto a US Doppler apresenta boa sensibilidade para seu diagnóstico, chegando a 98% em algumas séries (Clevert et al) quando comparado a técnicas de referência (tomografia computadorizada, ressonância magnética e angiografia digital por subtração). O achado ultrassonográfico característico consiste na presença de flap intimal ondulante intraluminal. O falso lúmen pode apresentar ou não fluxo no sentido anterógrado ou retrógrado.
– Doença aterosclerótica e estenoses:
Os critérios utilizados para a caracterização de estenoses na aorta e nas artérias ilíacas são similares aos utilizados para segmentos arteriais periféricos, levando-se em consideração a avaliação direta pelo modo B (US convencional), as relações entre as velocidades de pico sistólico (VPS) antes e após as placas / estreitamentos luminais suspeitos e as mudanças no padrão espectral do fluxo.
INDICAÇÕES DO EXAME:
- Investigação de trombose venosa, sobretudo na avaliação de eventual extensão de trombose venosa profunda (TVP) de membros inferiores e pelve para a VCI;
- Avaliação pós-operatória de filtro de VCI.
AVALIAÇÃO:
Paciente na posição supina, podendo ser necessária elevação dos membros inferiores, para aumento do fluxo e do calibre da VCI, facilitando sua visualização. Utiliza-se, preferencialmente, transdutor convexo com faixas de frequências baixas, entre 2,5 e 5 MHz.
A avaliação pode ser prejudicada em pacientes obesos ou com grande quantidade de conteúdo gasoso nas alças intestinais. Em pacientes desidratados ou em hipovolemia, a VCI pode apresentar-se com calibre bastante reduzido e sua análise pode também ser difícil, sobretudo no segmento infrarrenal.

Imagem de US com modo B adquirida ao longo do eixo longitudinal da veia cava inferior evidenciando estrutura ecogênica cilíndrica no seu interior, correspondente ao filtro de veia cava.
- Anatomia: através do modo B (US convencional) são pesquisadas variações anatômicas e avaliado o calibre da VCI, o que pode trazer informações sobre o estado de hidratação e variações da volemia do paciente, ou mesmo demonstrar a presença de aumento de calibre secundário a insuficiência cardíaca, por exemplo.
- Pesquisa de trombose: além da possibilidade de se identificar um trombo ao modo B como um material ecogênico obliterando parcial ou totalmente o lúmen da VCI, pode-se suspeitar de trombose mediante alguns sinais à US Doppler, como a perda da espontaneidade do fluxo e da fasicidade à respiração, e a ausência da interrupção momentânea do fluxo com durante a manobra de Valsalva;
- Avaliação de filtro de veia cava inferior: verificação do posicionamento do filtro, de suas características e pesquisa de trombo acima e/ou abaixo do nível do filtro.
Os segmentos venosos avaliados são a VCI e, complementarmente, também as veias ilíacas comuns, internas e externas.
INTERPRETAÇÃO DOS RESULTADOS:
– Trombose venosa: um trombo na VCI pode ocorrer isoladamente ou como extensão a partir de TVP de membros inferiores ou de segmentos venosos pélvicos. Trombose tumoral pode ser observada, por exemplo, associada a tumores renais ou carcinoma hepatocelular. Pode ocorrer, ainda, como resultado de invasão ou compressão extrínseca por tumores ou metástases retroperitoneais, ou mesmo por tumores intraperitoneais avançados.
– Filtro de VCI: há diversos tipos de filtros, contudo todos devem ser posicionados nos terços médio e inferior da VCI, abaixo da desembocadura das veias renais. Quando acima do plano das veias renais, houve provável migração. Há uma pequena chance de uma trombose ter extensão acima do plano do filtro, ou mesmo surgir junto a ele.
– Outras possíveis aplicações do método são a avaliação de shunts portocavais e de condições menos comuns, como fístulas entre a VCI e a aorta secundárias à aneurismas aórticos.
SISTEMA ARTERIAL PERIFÉRICO
INDICAÇÕES DO EXAME:
- Investigação de doença vascular periférica em pacientes com sintomas de isquemia dos membros superiores e inferiores;
- Avaliação pós-operatória de enxertos e próteses vasculares;
- Diagnóstico e seguimento de aneurismas de artérias periféricas;
- Diagnóstico e tratamento de pseudoaneurismas;
- Investigação de síndromes associadas à compressão arterial, como a Síndrome do Desfiladeiro Torácico (SDT) e Síndrome do aprisionamento da artéria poplítea (SAAP).
- Avaliação de shunts arteriovenosos para diálise.
AVALIAÇÃO:
Transdutores lineares de alta frequência (5-15 MHz) são utilizados, entretanto para artérias profundas e em pacientes edemaciados ou com panículo adiposo espesso, podem ser necessários transdutores convexos de baixa frequência 3-5 MHz).
A presença de estenoses significativas ou oclusões proximais resulta em hipoperfusão e redução da amplitude do fluxo distal, tornando passível de erro à pesquisa de estenoses em segmentos distais através dos critérios disponíveis; nestes casos duvidosos, outra modalidade diagnóstica pode ser utilizada.
- Anatomia: a avaliação tem início com o modo B, através do qual são pesquisadas variantes anatômicas e analisados os calibres e trajetos das artérias em estudo.
- Membros inferiores: os segmentos arteriais incluídos no estudo são as artérias tibial anterior, tibial posterior, fibular, poplítea, femoral superficial, femoral profunda e femoral comum. As artérias do pé não são usualmente examinadas, à exceção da porção proximal da artéria pediosa.
- Membros superiores: as artérias radial, ulnar, braquial, axilar e subclávia estão dentro do escopo do estudo.
- Caracterização de placas e pesquisa de estenoses hemodinamicamente significativas e oclusões: Ainda ao modo B, é possível a visualização de placas de ateromatose, caracterizando-as quanto ao grau de calcificação e à presença de irregularidades em suas superfícies, identificando áreas de estreitamento luminal suspeitas para estenoses que possam determinar repercussão hemodinâmica. Ao Doppler colorido, a presença de turbilhonamento do fluxo nas áreas suspeitas eleva este grau de suspeição e, por fim, com a determinação do padrão de fluxo (tri ou bifásico) e das velocidades de pico sistólico (VPS) com o uso do Doppler pulsado, é possível diagnosticar estenoses hemodinamicamente significativas.

Imagem de Doppler espectral demonstrando o padrão trifásico normal esperado para o fluxo em artérias periféricas.
- Avaliação pós-operatória de enxertos vasculares e endopróteses (stents):
- Enxertos vasculares: ao modo B, é possível localizar o enxerto e caracterizar seu tipo, extensão, origem e inserção. Apesar de haver critérios distintos para definição de estenose nos enxertos (tabela 5), os passos para sua pesquisa são semelhantes aos utilizados em artérias nativas, incluindo a avaliação ao modo B e ao Doppler pulsado e colorido. Trombose, pseudoaneurismas, hiperplasia miointimal difusa e outras complicações pós-operatórias são também pesquisados.
- Stents são identificados ao modo B (US convencional), por produzir intensa reflexão do feixe acústico em comparação às paredes arteriais. A pesquisa de estenoses segue os mesmos princípios já mencionados, destacando-se que no caso dos stents, empregam-se critérios para definição de estenoses significativas similares aos utilizados em quaisquer segmentos arteriais periféricos sem stents.
- Identificação de outras patologias, como pseudoaneurismas e fístulas arteriovenosas (FAV) pós-traumáticas ou pós-cateterização: a atenção durante todo o estudo é destinada para que se identifiquem eventuais patologias, que podem representar achados incidentais ou já estarem elencadas dentre as hipóteses diagnósticas. Modo B e Doppler contribuem para sua pesquisa e caracterização.
- Investigação de síndromes compressivas: nestes casos, o diagnóstico é auxiliado pelo uso de manobras dinâmicas. São pesquisadas, durante as manobras, mudanças no padrão de fluxo e aumento das velocidades ao Doppler colorido e pulsado. Na suspeita de Síndrome do Aprisionamento da Artéria Poplítea, a artéria poplítea deve ser avaliada inicialmente em repouso e depois durante manobras em dorso flexão passiva do pé e flexão plantar ativa. Já na investigação da Síndrome do Desfiladeiro Torácico, a artéria subclávia e a axilar ou braquial são examinadas durante manobras de “Adson”, costoclavicular e de hiperabdução do braço com o paciente na posição ereta ou supina. O papel da US Doppler na STD consiste na avaliação de casos em que há dúvida no diagnóstico clínico.
Dicas e observações:
- Pitfall: cuidado para não comprimir as artérias durante o exame com o transdutor, o que pode ocasionar aparência de falsa estenose.
- Regra geral para caracterização de estenoses:
- Na mesma artéria ou artérias contíguas: dobrar velocidade
- Em artérias com emergência terminolateral: triplicar a velocidade
- Iniciar pelos segmentos proximais. Se não houver alterações, só é necessário uma foto de cada segmento. Se houver alterações, documentá-las.
No antebraço e perna, iniciar pelo leito distal e ir avaliando no sentido caudocranial. Interessante notar que, se nos terços distais das artérias da perna ou do antebraço houver padrão trifásico do fluxo e for de boa amplitude, será pouco provável que sejam encontradas alterações proximais. Dessa forma, tirar essa foto do mais distal e avaliar retrogradamente os leitos mais proximais. Documentar eventuais alterações. - Muitas vezes, não são encontrados pontos de estenose significativa (aumento >2x da VPS), mas mesmo assim são observados fluxos com perda do padrão trifásico distal, bem como de baixa amplitude. Nestes casos, esta alteração de fluxo arterial no leito distal estará sendo causada por várias / múltiplas estenoses consecutivas menores do que 50%, que resultarão neste comprometimento distal. Neste caso, relatar: ateromatose difusa, que determina redução progressiva dos picos de velocidades sistólicas, com hipofluxo distal.
- Tomar cuidado com vasos recanalizados. Com o tempo, são formados inúmeros colaterais para suprir os leitos distais. Os vasos vão ficando tortuosos e muitas vezes as artérias com fluxo já não são as artérias nativas. Uma forma de se identificar isso, além da tortuosidade, é o fato de que algumas vezes, ao utilizar-se de um corte longitudinal para avaliação de uma artéria nativa, surgirão focos de fluxo pontual (como se o fluxo estivesse sendo cortado no axial… e realmente está) ao longo do vaso… houve tanta recanalização e formação de colaterais que o fluxo foi quase totalmente desviado do leito primitivo, somente cruzando-o nestes focos de fluxo pontual. Nestes casos, será importante relatar no laudo que a artéria em questão apresenta múltiplos pontos de oclusão, com reenchimento em diversos pontos de seu trajeto por colaterais adjacentes.
- Quando não se observa fluxo em um segmento arterial, procurar as veias (se estiverem com fluxo ao Doppler e não houver fluxo arterial junto, o qual deve ter amplitude maior, é sinal de oclusão do segmento arterial). As placas ateromatosas dão a dica de onde esta a artéria.
INTERPRETAÇÃO DOS RESULTADOS:
– Aterosclerose (placas, estenoses e oclusões):
A US Doppler permite uma avaliação acurada das principais artérias periféricas, determinando a extensão e a gravidade da doença aterosclerótica.
Os principais critérios diagnósticos para estenoses são a avaliação direta pelo modo B (US convencional) e as relações entre as velocidades de pico sistólico (VPS) antes e após as placas suspeitas (tabela abaixo). Sinais indiretos, como a presença de colaterais junto ao leito arterial e a mudança no padrão espectral do fluxo ao Doppler pulsado entre dois níveis podem auxiliar na detecção de áreas de estenose significativa.
Em alguns pacientes, a doença aterosclerótica avançada condiciona redução da amplitude do fluxo nos segmentos distais e hipoperfusão mesmo sem a presença de estenoses focais significativas.
Em casos de oclusão, não é detectado fluxo ao Doppler colorido ou pulsado.
Nos membros superiores, o padrão de distribuição das lesões é distinto em relação aos inferiores, uma vez que os quadros isquêmicos nos braços resultam principalmente de compressão, embolia ou vasoespasmo e, menos frequentemente estão relacionados à ateromatose.

Estenose da artéria femoral superficial esquerda (AFSE). Ao modo B (A) observam-se placas ateromatosas predominantemente calcificadas ao longo das paredes da artéria e, na região apontada pela seta, estreitamento mais pronunciado do que nos demais segmentos, suspeito para estenose significativa. Na região suspeita, nota-se turbilhonamento (aliasing) ao Doppler colorido (B) e aumento da velocidade de pico sistólico (VPS) de 98,7 cm/s para 336 cm/s, caracterizando estenose hemodinamicamente significativa entre 50 e 75% (C).
| CRITÉRIOS PARA ESTENOSES EM ARTÉRIAS PERIFÉRICAS | |||
| Grau de estenose (%) | VPS | VPS na estenose / VPS pré-estenose | Doppler colorido e pulsado |
| Normal | < 150 cm/s | <1,5 | Trifásico com fluxo laminar |
| 1-49% | 150-200 cm/s | 1,5-2,0 | Trifásico, surgindo “borramento” do fluxo ao Doppler colorido conforme a estenose se aproxima de 49% |
| 50-75% | 200-400 cm/s | 2,0-4,0 | Tri ou bifásico e padrão “tardus parvus” distal |
| >75% | >400 cm/s | >4,0 | Pré-estenose: Tri ou bifásico
Pós-estenose: “tardus parvus” |
| Oclusão | Sem fluxo | – | Pré-oclusão: Bifásico / staccato
Pós-oclusão: ausência de fluxo, com “tardus parvus” após área de reenchimento por colaterais |
– Avaliação pós-operatória de stents e enxertos vasculares:
Os critérios utilizados para definição de estenose em stents são os mesmos empregados para estenoses em artérias sem stents e estão resumidos na tabela acima.
Enxertos vasculares podem ser constituídos por veias autólogas ou materiais sintéticos. Diversos fatores podem resultar na falência do enxerto, como estenose (nas anastomoses ou nas áreas centrais), trombose, hiperplasia miointimal difusa, infecção do sítio cirúrgico, coleções pós-operatórias comprimindo extrinsecamente o enxerto, deiscência das anastomoses, além de eventual desenvolvimento de pseudoaneurismas e fístulas arteriovenosas. Cada uma das complicações ocorre mais comumente em um intervalo de tempo específico após a cirurgia, destacando-se: compressão extrínseca por coleções ou infecção do sítio cirúrgico costuma ocorrer nos primeiros dias de pós-operatório; entre 6-8 semanas, usualmente a falência está associada a falhas na técnica cirúrgica; entre 3 meses e 2 anos, a hiperplasia miointimal difusa é comum; após 2 anos, frequentemente a perda do enxerto se deve à progressão da aterosclerose. Cerca de 70-80% das falências ocorrem nos primeiros 2 anos.
A avaliação de enxertos sintéticos é mais difícil em relação aos venosos e a maioria de suas complicações ocorre nas anastomoses; já em enxertos venosos, em contrapartida, ocorrem em toda sua extensão.
Os principais critérios para definição de estenoses em enxertos vasculares e associados a risco de falência estão resumidos na tabela abaixo.
O seguimento pós-operatório com US Doppler reduz a taxa de falência do enxerto, principalmente dos derivados de veias autólogas.
| CRITÉRIOS PARA DEFINIÇÃO DE ESTENOSE EM ENXERTOS VASCULARES AO DOPPLER | |
| Medida do diâmetro antes e na estenose | 50-70% de redução do calibre: estenose moderada
>70% de redução do calibre: estenose grave |
| Valor absoluto de velocidade de pico sistólico (VPS) | 150-250 cm/s = estenose entre 50-70%
>250 cm/s = estenose >70% |
| Valor absoluto de velocidade diastólica final (VDF) | >100 cm/s = estenose >70% |
| Relação entre VPS após e antes da estenose | 2,5-3,5 = estenose entre 50-70%
>3,5 = estenose >70% |
– Pseudoaneurismas: são “hematomas” que mantém uma área interna de fluxo sanguíneo extravascular, que apresenta comunicação com a artéria de origem através de um colo; com o tempo, há o desenvolvimento de uma cápsula fibrosa ao redor do pseudoaneurisma. Surgem após traumas ou cateterizações arteriais. Aparece como uma coleção fluida complexa ao modo B, com ou sem loculações, situada junto a uma artéria. Ao Doppler colorido, demonstra pulsatilidade e fluxo interno, sendo comum o aspecto de redemoinho, também chamado de “yin-yang”, por ter uma metade colorida em vermelho e outra em azul (sentidos opostos). A análise da região do colo ao Doppler evidencia fluxo que durante a sístole ocorre em direção ao pseudoaneurisma e tem sentido oposto na diástole. Trombos murais podem estar presentes e o pseudoaneurisma pode ser composto de várias lojas conectadas. A US Doppler pode ainda ser utilizada para o seu tratamento (trombose) através de compressão sobre o pseudoaneurisma ou da injeção de trombina guiadas por imagem.

Pseudoaneurisma da artéria femoral superficial direita (setas), caracterizado ao Doppler colorido pelo sinal do redemoinho ou “yin-yang”. A análise do colo do pseudoaneurisma ao Doppler espectral evidencia fluxos em sentidos opostos de entra e sai (to-and-fro) durante a sístole e a diástole.
– FAV pós-traumáticas ou iatrogênicas: Ao Doppler, o fluxo no interior de FAVs caracteriza-se por baixa resistência com alta amplitude que se mantém na diástole. Na veia de drenagem, observa-se fluxo turbulento e arterializado. Nos membros inferiores, comumente ocorrem distalmente à bifurcação da artéria femoral comum, pois a partir deste ponto a veia cursa junto e posteriormente à artéria, aumentando a chance de punção acidental simultânea de ambas, predispondo a sua formação; além disso, uma tributária da veia femoral comum frequentemente tem trajeto entre as artérias femorais profunda e superficial, podendo também ser a veia envolvida na formação da FAV.
– Síndromes compressivas: o diagnóstico é sugerido quando há turbilhonamento do fluxo e aumento significativo de sua velocidade às manobras dinâmicas.
SISTEMA VENOSO PERIFÉRICO
A US Doppler é o método de escolha para a pesquisa de TVP. Sua importância reside no fato de o quadro clínico ser inespecífico e muitas vezes falível.
A maioria dos trombos é formada nas veias da panturrilha e, aproximadamente, 20 a 30% têm extensão proximal, aumentando o risco de tromboembolismo pulmonar (TEP). Trombose isolada no segmento ilíaco ou na VCI é incomum, chegando à frequência de 20% segundo o estudo de Spritzer et al. Pacientes com TVP não tratada em uma das veias femorais comuns, das ilíacas ou na VCI têm risco de TEP de cerca de 50%.
SEGMENTOS VENOSOS AVALIADOS:
- Membros inferiores
Veias tibiais anteriores, tibiais posteriores, fibulares, poplítea(s), femoral superficial, femoral comum e o segmento proximal da veia femoral profunda são avaliados. A avaliação inclui também as veias intramusculares gastrocnêmias e soleares, além da confluência entre as veias safena magna e femoral comum.
Caso sejam observados sinais de TVP que atinja a veia femoral comum, o estudo dos segmentos venosos proximais é mandatório para apreciação da extensão do trombo.

Anatomia do sistema venoso profundo (direita) e superficial (esquerda) do membro inferior.
- Membros superiores
Veias radiais, ulnares, braquiais, axilar e subclávia, além avaliação do sistema superficial, que inclui as veias cefálica e basílica. Da mesma forma que nos membros inferiores, também deve ser pesquisada extensão proximal do trombo.

Anatomia do sistema venoso do membro superior.
CONCEITOS TÉCNICOS:
Paciente na posição supina ou, caso haja dificuldade na identificação das veias, em Trendelenburg reverso ou sentado, para tornar o sistema venoso congesto e conspícuo. Preferencialmente, transdutores lineares de alta frequência (5-15 MHz) são empregados, contudo podem ser necessários transdutores convexos de baixa frequência (3-5 MHz) em alguns segmentos, como as veias ilíacas, e em pacientes edemaciados ou obesos.
Os principais parâmetros analisados são:
- Compressibilidade;
- Espontaneidade do fluxo;
- Fasicidade à respiração;
- Interrupção momentânea do fluxo com a manobra de Valsalva;
- Aumento do fluxo com a compressão distal.
O principal método para investigação de TVP à US Doppler é a compressão venosa, ou seja, a aplicação sistemática de pressão sobre todo o trajeto venoso com o transdutor enquanto são obtidas imagens com o modo B. Quando não há trombo, as veias se colapsam à compressão, uma vez que apresentam paredes finas – o mesmo não ocorre com as artérias.

Imagens ao modo B demonstrando as veias femorais (VF1 e VF2) junto à artéria femoral superficial (AFS) à análise sem compressão (esquerda) e colapsadas durante a compressão (direita); Ausência de trombose.
A avaliação com Doppler colorido e pulsátil é complementar. As seguintes características do fluxo são analisadas: espontaneidade, fasicidade, direção e aumento da amplitude à compressão distal.
Normalmente, o fluxo venoso é fásico à respiração, apresentando aumento de sua amplitude à inspiração e redução à expiração. À manobra de Valsalva, espera-se que haja interrupção momentânea do fluxo e que o diâmetro da veia apresente incremento entre 50 e 200%. Tanto a manobra de Valsalva quanto a verificação da fasicidade respiratória são utilizadas para a pesquisa indireta de TVP proximalmente ao segmento analisado.

Fluxo venoso normal, mostrando fasicidade habitual e fluxo espontâneo ao Doppler espectral.

Doppler espectral evidencia o aumento esperado normal (seta) do fluxo venoso na veia femoral à inspiração profunda.

Resposta normal à manobra de Valsalva. Doppler espectral evidencia interrupção do fluxo anterógrado (seta) durante a manobra de Valsalva. Após a manobra, observa-se novamente o fluxo anterógrado.
Outra manobra utilizada é a compressão sobre veias distais ao segmento venoso analisado, esperando-se, na ausência de TVP, aumento da amplitude do fluxo anterógrado. Esta manobra é útil em veias das pernas e antebraços que, por serem mais distais, sofrem menor influência das variações de pressão intratorácica e, ao contrário das duas manobras mencionadas acima, é empregada para pesquisa indireta de TVP distalmente ao segmento analisado.
Outras patologias que poderiam justificar o quadro clínico do paciente são também pesquisadas, como tromboflebite superficial ou cisto de Baker complicado, por exemplo.
Panículo adiposo espesso e edema dos planos superficiais podem prejudicar a realização do estudo.
INTERPRETAÇÃO DOS RESULTADOS:
Redução da compressibilidade e observação de trombo oclusivo / suboclusivo ao modo B, além da ausência de fluxo ao Doppler são os principais critérios para o diagnóstico de TVP.

Trombose da veia femoral comum. Nestas imagens ao modo B, observa-se redução da compressibilidade da veia femoral comum comparando-se as imagens adquiridas sem compressão (esquerda) e com compressão (direita). Há material ecogênico preenchendo o lúmen da veia (setas).
A ausência de fasicidade à respiração, a falta de resposta à manobra de Valsalva e a ausência de aumento do fluxo anterógrado durante a compressão venosa distal são sinais indiretos e não específicos de TVP proximal ou distalmente ao segmento venoso testado (ver acima).
Além da presença ou ausência de TVP, a US Doppler permite estabelecer se a trombose é recente (oclusão completa) ou não, situação em que pode ser referida como TVP pregressa parcial ou totalmente recanalizada.
Na fase aguda, o trombo tende a ser mais hipoecogênico e o calibre da veia costuma estar aumentado. Com a evolução, ocorre redução do calibre venoso e a tendência é que o trombo se torne mais ecogênico, sofra reorganização e tenha início o processo de recanalização, a qual é completa em apenas 20% dos casos. Muitas anormalidades podem persistir cronicamente, como espessamento parietal, redução do calibre e presença de traves fibrosas dentro do lúmen venoso. Veias colaterais calibrosas podem ser observadas tanto na fase aguda como na crônica.

TVP parcialmente recanalizada. Imagem de modo B (esquerda) e Doppler colorido (direita) evidenciam redução da compressibilidade da veia femoral comum esquerda (imagem da esquerda sem compressão e imagem da direita sob compressão). É possível observar trombo hiperecogênico obliterando parcialmente o lúmen da veia femoral comum, com fluxo em sua periferia ao Doppler colorido (setas). CFV: veia femoral comum; CFA: artéria femoral comum.

Outro exemplo de TVP parcialmente recanalizada. Imagens de modo B (A) revelam redução da compressibilidade da veia femoral (imagem da esquerda sem compressão e imagem da direita sob compressão). Imagem de Doppler colorido (B) evidencia trombo hiperecogênico obliterando parcialmente o lúmen da veia femoral e fluxo em sua periferia (em azul). FV: veia femoral; FA: artéria femoral.

TVP recente, com oclusão luminal completa (não recanalizado). Imagens de modo B (A) revelam redução da compressibilidade da veia femoral (imagem da esquerda sem compressão e imagem da direita sob compressão). Imagem de Doppler colorido (B) evidencia trombo obliterando totalmente o lúmen da veia femora, sem fluxo ao Doppler colorido. FA: artéria femoral; FV: veia femoral; PFV: veia femoral profunda.
A insuficiência venosa crônica dos membros inferiores é um problema comum. Cerca de 20-25% das mulheres e 10-15% dos homens têm veias varicosas visíveis. Doença avançada associada a úlceras venosas resulta em piora importante da qualidade de vida. Idade, sexo feminino, gestação e antecedente pessoal de TVP são alguns dos principais fatores de risco para a doença.
A US Doppler é um método não invasivo e o mais comumente empregado para a avaliação da insuficiência venosa dos membros inferiores.
ANÁLISE:
Em relação à US Doppler arterial, a avaliação do sistema venoso pode ser bastante desafiadora devido à ampla gama de variações anatômicas.
Todo o sistema venoso dos membros inferiores está incluído na avaliação, incluindo as veias profundas, superficiais e perfurantes. O principal objetivo é verificar sua competência e identificar a causa das varizes.
O sistema venoso profundo é delimitado pela fáscia muscular, a qual pode ser observada à US Doppler. O sistema superficial situa-se entre a fáscia muscular e a derme. As veias que conectam ambos os sistemas, atravessando a fáscia e penetrando planos musculares, são denominadas veias perfurantes. Algumas veias perfurantes têm epônimos específicos, destacando-se:
- Perfurantes de Cocket: em número de três, situadas na porção inferior e medial da perna, distando aproximadamente 6 cm, 13 cm e 18 cm acima do maléolo medial. Conectam ramos da veia safena magna às veias tibiais posteriores;
- Perfurante de Boyd: única e localizada na porção superior da perna, cerca de 10 cm abaixo do joelho. Conecta a veia safena magna ou um de seus ramos ao sistema das veias tibiais posteriores;
- Perfurante de Dodd: única e situada no terço médio da coxa, conectando a veia safena magna ou um de seus ramos à veia femoral superficial.

Veias perfurantes: visão medial à esquerda, e visão posterior à direita.
Os segmentos venosos profundos analisados são as veias tibiais anteriores, tibiais posteriores, fibulares, poplítea(s), femoral superficial, femoral profunda, femoral comum e as veias intramusculares gastrocnêmias e soleares.
Os principais troncos venosos superficiais avaliados são a veia safena magna e a safena parva. A região da junção safenofemoral é uma área a ser destacada, considerando haver pelo menos seis tributárias que ali desembocam e que podem ser a origem de veias varicosas primárias e recorrentes (figura a seguir).

Crossa da veia safena magna esquerda (VSIE) normal ao modo B (esquerda) e ao Doppler colorido (direita). VFCE: veia femoral comum esquerda.
A análise do sistema venoso inclui a pesquisa de trombose – TVP e tromboflebite superficial – e a avaliação da competência em toda rede venosa do membro inferior.
Os calibres das veias safenas magna e parva são verificados e outras veias varicosas do sistema superficial também são identificadas. É importante destacar que telangectasias superficiais não são visíveis à ultrassonografia.
CONCEITOS TÉCNICOS:
Transdutores lineares de alta frequência (5-15 MHz) são utilizados, entretanto em pacientes edemaciados ou com panículo adiposo espesso, pode-se dispor de transdutores convexos de baixa frequência (3-5 MHz).
Há diferentes protocolos de exame, variando entre instituições e de acordo com a preferência do ultrassonografista. O estudo deve ser realizado com paciente em ortostase (preferencialmente), ou na posição supina em Trendelenburg reverso (pelo menos 30º), ou ainda sentado.
A competência do sistema venoso pode ser determinada com o auxílio de algumas manobras que causam elevação temporária da pressão no interior das veias estudadas, permitindo verificar a funcionalidade de suas válvulas em momentos de maior solicitação. Na maior parte da população, há válvulas somente a partir (distalmente) das veias femorais superficiais. A competência da porção proximal da veia femoral superficial e da junção safenofemoral pode ser avaliada através da manobra de Valsalva (figura a seguir), a qual determina aumento das pressões intratorácica e intra-abdominal, que se propaga ao sistema venoso, permitindo a identificação de eventual refluxo (insuficiência). Para a avaliação das veias mais distais, este aumento da pressão venosa é obtido através de compressão sobre segmentos venosos distais à veia examinada seguida de rápida soltura; durante a compressão, há aumento do fluxo anterógrado e, após a soltura, a coluna de sangue tende a retornar no sentido oposto, provocando aumento pressórico. Já quando o objetivo é analisar a competência das veias perfurantes, o raciocínio é semelhante, contudo quando realizada a compressão, deve-se executá-la em posição proximal à perfurante em questão, determinando aumento pressórico tanto nas veias profundas como nas superficiais; caso não haja incompetência, espera-se que o fluxo ocorra do sistema superficial para o profundo.

Avaliação com Doppler colorido e espectral de junção safenofemoral competente durante manobra de Valsalva, demonstrando ausência de refluxo significativo. O momento em que o paciente começa a executar a manobra corresponde ao início da ascensão da curva espectral; observe que o fluxo se inverte (ultrapassa a linha de base) somente momentaneamente e com amplitude baixa, não caracterizando refluxo significativo.
A seguir, uma sugestão de protocolo / sequência para o exame:
- Avaliar sistema venoso profundo em decúbito dorsal, buscando sinais de TVP. Buscar sinais não somente de TVP aguda, mais também de TVP antiga recanalizada (paredes espessadas, pérvia) ou parcialmente recanalizada (parcialmente compressível, com trombo no seu interior, mas observando-se fluxo parcial ao Doppler).
- Paciente em ortostase e de frente para o examinador:
- Avaliar competência do sistema profundo (veia femoral superficial – não precisa da comum – e poplítea, principalmente… a veia poplítea será avaliada no item 3);
- Avaliar a crossa da safena magna (competência e calibre no terço proximal da coxa) e descer avaliando toda a safena magna. Medir também calibre
no terço distal da coxa e distal da perna; - Procurar perfurantes na coxa (em especial em sua face medial) e nas faces medial e anterolateral da perna;
- Repetir estes passos para o membro colateral (se tiver sido solicitado o estudo de ambos os membros).
- Paciente em ortostase e de costas para o examinador:
- Avaliar competência da veia poplítea;
- Avaliação da safena parva desde sua crossa até seu terço distal;
- Avaliação de perfurantes na face posterior da perna e eventualmente também da coxa (menos comum);
- Avaliar se há varizes superficiais e dar sua localização.
Manobras:
- Compressão distal, exceto quando avaliando perfurantes: deve ser realizada não mais do que 20-30 cm abaixo do local examinado. O “primeiro fluxo” que ocorre é anterógrado… O “segundo fluxo” que poderá aparecer é o refluxo, com sentido contrário. Isto se deve ao fato de que à compressão, ocorre um primeiro fluxo no sentido cranial e, com a interrupção da mesma, haverá uma coluna de sangue dentro da veia analisada que tenderá a retornar caudalmente… caso as válvulas estejam competentes, este refluxo será minimo e interrompido prontamente (há um estalido de fechamento valvular), ao passo de que se estiverem incompetentes, este fluxo retrógrado continuará por mais tempo (>1 seg).
- Manobra de Valsalva (e compressão distal quando as perfurantes forem os objetos de estudo): neste caso, o “primeiro fluxo” é o importante, pois se houver refluxo/incompetência este aparecerá já num primeiro momento. No caso da manobra de Valsalva há um aumento direto na coluna de pressão sobre as veias dos membros e, na presença de insuficiência, esta será notada neste momento, com fluxo no sentido caudal. No caso da compressão distal na avaliação das perfurantes, a explicação é que quando se comprime o leito venoso distal, tanto o sistema profundo quanto o superficial estão sofrendo compressão, e este volume de sangue é impelido cranialmente; neste momento, o fluxo nas perfurantes ocorrerá com sentido do superficial para o profundo (correto) ou, caso haja insuficiência das perfurantes, no sentido contrário.
LIMITAÇÕES:
Por ser um estudo trabalhoso e mais demorado, mesmo pacientes jovens podem sentir-se fadigados após longos períodos em ortostase. Em pacientes debilitados e com comorbidades, pode ser necessário realizar o exame na posição supina em Trendelenburg reverso (se possível) ou sentada.
Um possível fator de erro do estudo ocorre quando existem válvulas competentes nas veias ilíacas (comumente desprovidas de válvulas) impedindo o fluxo retrógrado de sangue em direção à junção safenofemoral e à veia femoral superficial durante a manobra de Valsalva, resultando em falha na detecção de eventual refluxo.
INTERPRETAÇÃO DOS RESULTADOS:
Veias competentes podem apresentar refluxo somente por curto período de tempo nos momentos em que há aumento da pressão da coluna de sangue no seu interior. Caso contrário, há insuficiência venosa.
Insuficiência venosa é definida pela presença de refluxo significativo (figura a seguir), caracterizado por fluxo retrógrado sustentado por período de tempo definido para cada parte do sistema venoso (tabela a seguir). O aumento do calibre é sinal indireto de insuficiência venosa (tabela a seguir).

Avaliação com Doppler espectral de veia safena magna insuficiente em seu trajeto na coxa demonstrando refluxo significativo à manobra de Valsalva. O início da manobra de Valsalva corresponde à região onde começa a ascensão da curva espectral. Note o fluxo retrógrado (acima da linha de base) com grande amplitude e sustentado até o fim do período representado na imagem (>>> 0,5 s), caracterizando refluxo significativo.
| TEMPOS DE FLUXO RETRÓGRADO DURANTE AS MANOBRAS DINÂMICAS QUE DEFINEM REFLUXO SIGNIFICATIVO | |
| Sistema superficial | > 0,5 s |
| Perfurantes | > 0,35 s |
| Sistema profundo | > 1,0 s |
| DIÂMETROS DA VEIA SAFENA MAGNA | |
| Veia safena magna | |
| Crossa | Até 7 mm |
| Coxa e Perna | Até 4 mm |
| Veia safena parva | |
| Crossa | Até 4 mm |
| Distal | Até 2 mm |
Varizes podem ser resultado de incompetência de qualquer porção do sistema venoso. Frequentemente, observa-se refluxo significativo nas junções safenofemoral e safenopoplítea, entretanto pode se apresentar de forma segmentar ou global nos diversos segmentos venosos.
Informações importantes fornecidas pelo estudo incluem o suprimento das áreas varicosas e os níveis em que estas veias estão incompetentes.
DICAS E OBSERVAÇÕES:
- Quando ha incompetência do profundo, o sistema superficial estará todo com calibre aumentado.
- Os locais aonde chegam tributarias / perfurantes são locais bons pra avaliar se há ou não refluxo (antes e após estes pontos).
- As veias perfurantes insuficientes são, quase sempre, mais calibrosas do que o habitual.
- Para relatar a localização das perfurantes incompetentes, utilizar uma régua e dar a distancia até a superfície plantar do pé ou ate a prega poplítea (quando na coxa).
- Como variante anatômica, pode-se encontrar a presença da veia safena magna acessória (veia safena accessória superficial) que se conecta com a safena magna em seus terços médio da coxa e proximal da perna, diferenciando-se da safena magna por seu trajeto mais superficial, enquanto a magna apresenta curso junto à fáscia muscular.
- Importante: na dúvida se há ou não refluxo, preferir não relatá-lo. Quando o refluxo é de amplitude muito baixa (quase junto à linha de base) ou com duração limítrofe e, forem empregadas as manobras corretas para sua avaliação, não relatá-lo. O refluxo real têm sentido contrário ao fluxo habitual e com amplitude semelhante (ou pouco menor) do que ele.
A US Doppler tem papel fundamental para auxiliar na escolha dos melhores vasos para a intervenção cirúrgica.
O acesso para hemodiálise é providenciado preferencialmente por meio de FAVH nos membros superiores, ou também através de cateteres centrais ou próteses quando a opção das fístulas não é factível. As FAVH apresentam maior durabilidade e menor risco de infecção em relação às próteses, entretanto cerca de 28-53% das FAVH nunca maturam, e as que maturam levam em média 2 a 4 meses antes de poderem ser utilizadas; é necessário que haja antes fluxo sanguíneo adequado e dilatação da veia de drenagem. Caso não haja maturação em 6 meses, são consideradas inviáveis. Em contrapartida, uma prótese pode ser usada a partir de duas semanas de sua colocação.
A US Doppler pré-operatória contribui para a redução das taxas de insucesso das FAVH e do número de explorações cirúrgicas desnecessárias.
ANÁLISE:
O principal parâmetro utilizado para a escolha dos vasos empregados na confecção da FAVH é o diâmetro dos vasos, principalmente o das veias. Além disso, outro objetivo importante do exame é investigar tromboses e estenoses nos segmentos vasculares avaliados. São avaliados os diâmetros luminais em diversos segmentos arteriais e venosos:
- das artérias radial e ulnar e das veias cefálica (figura a seguir) e basílica em suas porções proximais e distais;
- da ramificação cubital mediana da veia cefálica;
- das veias braquiais e axilares (em casos do uso de prótese);
- da artéria braquial na região antecubital ou imediatamente antes de sua bifurcação.

Imagem com modo B, demonstrado a medida do diâmetro da veia cefálica esquerda.
O estudo inclui também a avaliação de variações anatômicas e a pesquisa, no membro em que se pretende confeccionar a FAVH, de trombose no sistema venoso superficial e profundo, bem como a avaliação das artérias para identificação de estenoses significativas ou tromboses.
Quando não é encontrada anatomia favorável no antebraço, são mapeados os vasos do braço e, se necessário, também os axilares. Em último caso, se necessário, podem ser também avaliadas as raízes das coxas.
As profundidades em que se encontram as potenciais veias para o procedimento também são verificadas, pois caso estejam mais profundas do que 0,5 cm, pode ser necessário procedimento adicional para superficialização. Além disso, uma veia adequada ao procedimento deve apresentar livre comunicação com o sistema profundo.
CONCEITOS TÉCNICOS:
O exame é realizado preferencialmente com o paciente sentado (com garroteamento proximal somente para a análise do sistema venoso superficial), com o antebraço supinado em discreta abdução (45º), apoiado sobre toalhas em uma pequena mesa ou travesseiro. Em geral, transdutores lineares de alta frequência (7 MHz ou maior) são utilizados.
LIMITAÇÕES:
A principal limitação consiste na dificuldade técnica para a avaliação da patência das veias centrais, devido à profundidade dessas estruturas no tórax. O estudo é dificultado na presença de panículo adiposo espesso ou quando há edema acentuado de planos superficiais; nestes casos, pode ser necessário o uso de transdutores com frequências menores.
INTERPRETAÇÃO DOS RESULTADOS:
A tabela abaixo exemplifica valores de diâmetros mínimos que podem ser utilizados como pré-requisitos para a confecção de FAVH e de próteses. Caso os diâmetros internos dos vasos sejam satisfatórios e não haja tromboses venosas, ou estenoses e oclusões arteriais, as FAVH são preferencialmente confeccionadas no membro superior não dominante, o mais distal possível. Se o acesso obtido não for adequado ou não for possível utilizar este sítio anatômico, usualmente respeita-se uma ordem para a tentativa de novos acessos vasculares: no antebraço dominante, depois em um dos braços. Posteriormente, há a opção de prótese em um dos membros superiores e, em último caso, na raiz das coxas. Cateteres são reservados para a última opção.
| DIÂMETROS INTERNOS MÍNIMOS PARA CRIAÇÃO DE FAVH E PRÓTESES | |
| Vaso | Diâmetro mínimo (cm) |
| Veia para FAVH | 0,25 |
| Veia para prótese | 0,40 |
| Artéria (prótese ou FAVH) | 0,20 |
Há parâmetros à US Doppler que podem ser utilizados como preditores do sucesso das FAVH, como o teste de hiperemia reativa (HR) e a avaliação da velocidade de pico sistólico (VPS) na artéria selecionada.
O teste da HR tenta simular a resposta de declínio da resistência vascular após a construção da FAVH e a habilidade da artéria em sustentar o aumento do fluxo: registram-se o espectro e índice de resistividade (IR) da onda enquanto o punho está cerrado e, 2 min depois que o punho se manteve cerrado, registram-se os mesmos valores na transição para o fluxo com a mão aberta. Um IR < 0,7 na fase de hiperemia reativa correlaciona-se positivamente com o sucesso das FAVH. Já em relação à VPS na artéria selecionada, Sedlacek et al sugeriu que valores maiores que 50 cm/s são preditores de sucesso.
O acesso para hemodiálise é providenciado preferencialmente por meio de FAVH nos membros superiores, ou também através de cateteres centrais ou próteses quando a opção das fístulas não é factível. As FAVH apresentam maior durabilidade e menor risco de infecção em relação às próteses, entretanto cerca de 28-53% das FAVH nunca maturam, e as que maturam levam em média 2 a 4 meses antes de poderem ser utilizadas; é necessário que haja antes fluxo sanguíneo adequado e dilatação da veia de drenagem. Caso não haja maturação em 6 meses, são consideradas inviáveis. Em contrapartida, uma prótese pode ser usada a partir de duas semanas de sua colocação.
Na avaliação pós-operatória de FAVH e próteses, permite avaliar parâmetros relacionados à maturação das FAVH, além da investigação de eventuais complicações, como flebites, estenoses, pseudoaneurismas, hematomas e tromboses.
ANÁLISE:
- Avaliação geral da FAVH: caracterização de quais vasos compõe a FAVH e pesquisa de tromboses, estenoses e espessamento parietal. Os calibres da veia de drenagem (VD) são avaliados, com foco em seu segmento de menor diâmetro;
- Análise ao Doppler pulsado do padrão de fluxo e das velocidades na artéria nutridora (AN), na anastomose e na veia de drenagem (VD);
- Estimativa do volume de fluxo através na veia de drenagem – se insuficiente, adequado ou excessivo.
Iniciar o exame localizando a fístula e seus componentes (radiocefálica, braquiocefálica, ulnobasílica, etc.). Avalia-se perviedade da fístula, estenoses na
anastomose e na veia de drenagem, trombose da veia de drenagem, padrão de fluxo na artéria proximal e na veia de drenagem.
INTERPRETAÇÃO DOS RESULTADOS:
- Avaliação do fluxo na FAVH: em FAVH maduras, espera-se padrão de fluxo bifásico, de baixa resistência e com fluxo diastólico aumentado na AN. No local da anastomose, espera-se fluxo turbilhonado, sem aumentos focais de velocidade. Na VD, esperam-se paredes espessadas, com fluxo arterializado (velocidade alta, pulsátil, de baixa resistência). A observação de padrão trifásico na AN indica mal funcionamento da FAVH, sinalizando alta resistência distal. Na análise da VD, valores de fluxo médios superiores a 500 mL/min associados a um calibre maior que 0,4 cm predizem corretamente a maturidade em 95% das vezes. Entretanto, é importante ressaltar que a estimativa do volume de fluxo pela US Doppler não é precisa, sendo bastante suscetível a erros.
- Estenoses ou oclusões: estenoses ocorrem principalmente na região da anastomose ou na VD (próximo à FAVH ou mais distal). Quando há áreas de estreitamento luminal suspeitas para estenose, são verificadas as velocidades antes e após este ponto. Também é investigada estenose justa-anastomótica através da análise da velocidade de pico sistólico (VPS) na anastomose e cerca de 2,0 cm proximalmente a ela, na AN. A relação entre estas VPS serve para determinar se há ou não estenose significativa (>50%) de acordo com a tabela abaixo. Outros possíveis achados são oclusões da fístula ou trombose da VD.
| CRITÉRIOS PARA DEFINIÇÃO DE ESTENOSE MAIOR QUE 50% EM FAVH | |
| Estenose justa-anastomótica | Relação entre as VPS > 3:1 |
| Estenose da veia de drenagem (VD) | Relação entre as VPS > 3:1 |
| Estenose da artéria doadora | Relação entre as VPS > 2:1 |
- A presença de ramos venosos calibrosos nos primeiros 10 cm da VD pode estar associada a desvio de quantidade significativa de fluxo, com consequente retardo ou impedimento do processo de maturação. A ligadura destes vasos poderia aumentar as chances de sucesso da FAVH.
- Roubo do fluxo arterial distal pode ocorrer em FAVH, sobretudo durante a diálise. O roubo arterial pode ser diagnosticado pela identificação de fluxo invertido nas artérias distais à FAVH, contudo este achado pode ser assintomático e sem importância clínica se houver compensação através do arco palmar.
O acesso para hemodiálise é providenciado preferencialmente por meio de FAVH nos membros superiores, ou também através de cateteres centrais ou próteses quando a opção das fístulas não é factível. As FAVH apresentam maior durabilidade e menor risco de infecção em relação às próteses, entretanto cerca de 28-53% das FAVH nunca maturam, e as que maturam levam em média 2 a 4 meses antes de poderem ser utilizadas; é necessário que haja antes fluxo sanguíneo adequado e dilatação da veia de drenagem. Caso não haja maturação em 6 meses, são consideradas inviáveis. Em contrapartida, uma prótese pode ser usada a partir de duas semanas de sua colocação.
Na avaliação pós-operatória de FAVH e próteses, permite avaliar parâmetros relacionados à maturação das FAVH, além da investigação de eventuais complicações, como flebites, estenoses, pseudoaneurismas, hematomas e tromboses.
ANÁLISE:
- Avaliação geral da prótese: identificação dos vasos aos quais está anastomosada e investigação de tromboses, estenoses, coleções e pseudoaneurismas;
- A avaliação com Doppler pulsado é realizada na artéria nutridora da prótese (AN), na anastomose arterial, no corpo da prótese, na anastomose venosa e na(s) veia(s) de drenagem (VD), através da análise das curvas espectrais de velocidades e da pesquisa de estenoses.
- A pesquisa de trombose das veias jugular interna e subclávia é realizada rotineiramente.
INTERPRETAÇÃO DE RESULTADOS:
- Estenoses ou oclusões: as VPS são obtidas no corpo da prótese, na região da anastomose venosa e na porção distal da AN, cerca de 2 cm antes da anastomose arterial; a relação entre estas VPS é utilizada para caracterização de eventual estenose hemodinamicamente significativa e os valores de referência usados estão na tabela abaixo. Caso sejam observadas áreas de estreitamento luminal suspeitas, são verificadas as VPS antes e após este ponto e, através dos mesmos critérios, verifica-se se o aumento da velocidade é suficiente para definição de estenose significativa.
- Tal como foi mencionado para FAVH, pode haver também roubo arterial com o uso de próteses. Pseudoaneurismas, coleções e trombose de veias centrais podem também ser identificados.
| CRITÉRIOS PARA DEFINIÇÃO DE ESTENOSE EM PRÓTESES PARA HEMODIÁLISE | |
| Estenose moderada | Relação entre as VPS entre 2:1 e 3:1 |
| Estenose grave | Relação entre as VPS ≥ 3:1 |
DOPPLER VISCERAL ABDOMINAL
TIPOS DE CIRURGIA:
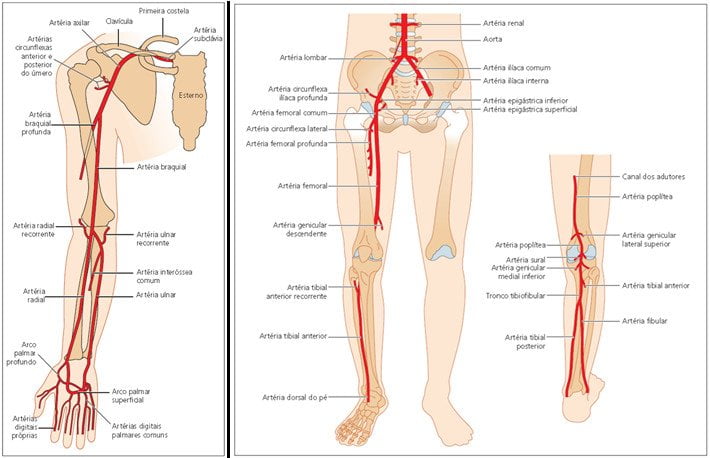
- Convencional: enxerto de cadáver, enxerto total ou reduzido (Split Liver – Lobo direito para adulto e lobo esquerdo para criança).
- Piggyback: intervivos. Enxerto do lobo direito. Anastomose de segmento curto VCI retro-hepática do doador com a VCI do receptor.
TÉCNICA DO EXAME:
Modo B
Iniciar com avaliação pelo modo B. São esperados os seguintes achados:
- Áreas heterogêneas no parênquima hepático
- Líquido ao redor do falciforme ou Morrison
- Estreitamentos nos pontos de anastomose
- Pequenos trombos na veia porta ou VCI.
- Perrame pleural à direita
- Halo periportal (edema)
Doppler
- Veias hepáticas: avaliar perviedade e fasicidade, bem como a(s) anastomose(s) venosa(s).
- Artérias hepáticas: avaliar VPS (velocidade de pico sistólico) e IR (índice de resistividade) no hilo; avaliar IR nas artérias hepáticas esquerda e direita. O parâmetro mais importante é o IR no hilo. Tentar identificar a anastomose arterial (mais fácil em crianças). Se a anastomose não for identificada, avaliar velocidades no segmento extra-hepático da artéria, buscando aumentos focais de velocidade (possíveis estenoses). Medir velocidade pré e pós anastomose (quando identificada) ou pré e pós ponto de aumento de VPS.
- Veia Porta: avaliar velocidade e padrão espectral na veia porta e seus ramos direito e esquerdo, avaliando também a anastomose venosa portal
Achados esperados ao Doppler:
- Fluxo nas veias hepáticas e veia cava inferior (normal multifásico) pode ser pulsátil ou continuo no pós-operatório recente.
- Artéria hepática – velocidade ate 200. Fluxo bifásico de baixa resistência (IR de 0,5 a 0,8 ). Tempo de aceleração < 0,08 s. O fluxo pode ser de alta
resistência até 72h após o transplante (ocorre em 45% dos casos), sem significado clínico.
As imagens pós-operatórias imediatas, obtidas quando os efeitos da cirurgia são muito recentes, frequentemente revelam uma série de achados que podem parecer alarmantes, mas tendem a normalizar em poucos dias e são compatíveis com as alterações relacionadas à própria cirurgia. Esses achados incluem aparência de “céu estrelado” de edema hepático por reperfusão, focos transitórios de aumento da ecogenicidade, pneumobilia, pequenas coleções fluidas, hematomas peri-hepáticos, derrame pleural, elevação temporária da velocidade arterial hepática, elevação transitória do índice de resistividade (IR) – pode chegar a 1,0 -, diminuição do IR com forma de onda tardus parvus, aumento do fluxo venoso portal e formas de onda mono ou bifásicas das veias hepáticas. A maioria dessas alterações volta ao normal na primeira semana de pós-operatório; deterioração atípica dessas mudanças transitórias requer avaliação adicional.
Sanyal R et al. Orthotopic liver transplantation: reversible Doppler US findings in the immediate postoperative period. Radiographics. 2012 JanFeb;32(1):199-211.
POSSÍVEIS ALTERAÇÕES:
Complicações relacionadas ao transplante hepático.
Rejeição é a causa mais comum de falência do enxerto. Diagnostico de rejeição é pela biopsia. Critérios inespecíficos: IR na artéria hepática < 0,5 ou > 0,8; fluxo monofásico nas veias hepáticas; halo periportal – edema linfático. SÃO CRITÉRIOS INESPECÍFICOS VISTOS EM DIFERENTES SITUAÇÕES.
Papel da imagem é identificar condições (eventualmente tratáveis) que mimetizam uma rejeição aguda.
1) Complicações vasculares
- Trombose da artéria hepática – maior parte das complicações vasculares agudas. Mais comum em crianças. Mortalidade alta. Diagnóstico precoce reduz
complicações biliares. Tratamento: trombectomia e reconstrução vascular. Há sintomas. Erros no diagnostico. A redução acentuada do fluxo arterial pode ocorrer no edema do fígado, na hipotensão sistêmica, na estenose acentuada, na rejeição e no transplante “small for size“. - Estenose da artéria hepática: relaciona-se à técnica cirúrgica (lesão intimal). Sintomas ausentes. Alterações enzimáticas isoladas. Perda do enxerto por
isquemia, depois trombose e rejeição. Importante diagnostico precoce. Tratamento: angioplastia e reconstrução vascular. Critérios diagnósticos:- Aumento focal da velocidade > 200 / ou 3x
- Fluxo turbulento pós-estenótico
- Tardus-parvus intra-hepático (IR < 0,5)
- Tempo de aceleração prolongado (> 0,08 s)
- Especificidade 81% / sensibilidade 60%
- Pseudoaneurisma da artéria hepática
- Trombose / estenose da veia porta
- Pode ser falseada por baixo fluxo portal – persistência de colaterais portossistemicas
- Pode ser falseada por resistência vascular distal aumentada – estenose da VCI / VV hepáticas
- A trombose parcial da veia porta não tem significado clinico.
- Na estenose da veia porta, há persistência do fluxo em espiral. Dilatação pós-anastomose. Há aumento da velocidade na estenose (> 3-4x) ou > velocidade ≥ 125 cm/s. Sinais de hipertensão portal.
- Trombose ou estenose de veias hepáticas ou da veia cava inferior
- Estenose da VCI infra-hepática: edema MMII
- Estenose da VCI supra-hepática: Budd-Chiari
- Estenose: aumento de velocidade de 4x entre pré/pós estenótico
- Fluxo reverso ou monofásico nas veias hepáticas
2) Complicações biliares (fatores desencadeantes: trombose / estenose da artéria hepática, tipo de anastomose utilizada)
- Obstrução biliar, cálculos ou estenose da via biliar
- Biloma e fístula biliar
- Estenoses ocorrem mais tardiamente do que fistulas
Exame de escolha é a colangioRM ou colangiografia.
3) Outras complicações
- Infecção , abscesso
- Hematoma
- Neoplasia
- Cirrose e complicações
- Perfuração intestinal
| Valores de normalidade no US Doppler | ||||
| Diâmetro | Padrão de fluxo | Velocidade | Outros | |
| Veia porta | < 1,2 cm | pulsátil / oscilatório | > 12 a 15 cm/s | Jovens e IMC ↓ Veloc. e pulsat. ↑ |
| Artéria hepática(*) | 3,4 mm (+/- 0,7 mm) | bifásico | 77,8 cm/s (+/- 39,3 cm/s) | IR = 0,70 (+/- 0,06) IP = 1,34 (+/- 0,31) |
| Veia esplênica | < 0,9 cm | pulsátil / oscilatório | n/a | n/a |
| Veia mesentérica superior | < 0,9 cm | pulsátil / oscilatório | n/a | n/a |
| Veias hepáticas | ≤ 1,0 cm / 2,0 cm da VCI | multifásico | n/a | entre 10ª semana gestação e 8ª semana puerpério: ∆s normais monofásicos |
REX SHUNT
Rex-shunt = procurar no hilo hepático. Interposição de segmento de veia jugular entre a veia mesentérica superior (ou junção esplenomesentérica) e veia
porta para ultrapassar trombose da porta. Procurar o REX e sua anastomose.
TIPS
O fluxo do ramo portal esquerdo deve ter sentido em direção ao shunt
A velocidade no tronco da veia porta deve ser maior do que 40 cm/s
Velocidade no shunt:
- Normal: 50-200 cm/s
- Anormal: Gradiente de velocidade >100
| Valores de referência para TIPS | |||
| Base (cm/s) | Estenose (cm/s) | Valor de p | |
| Velocidade no TIPS | 150,4 cm/s (+/- 37,96 cm/s) | 230,5 cm/s (+/- 168,5 cm/s) | p=0,0549 |
| Velocidade na veia porta | 50,8 cm/s (+/- 15,24 cm/s) | 26,2 cm/s (+/- 10,03 cm/s) | p<0,001 |
| Gradiente (proximal – distal) | 18,06 cm/s (+/- 0,5-88 cm/s) | 149,14 cm/s (+/- 108 – 400 cm/s) | p=0,006 |
INDICAÇÕES:
- Rastreamento de doença renovascular;
- Avaliação pós-operatória de angioplastia;
- Investigação do envolvimento das AR por aneurismas ou dissecções da aorta abdominal;
- Patologias das veias renais: trombose, Síndrome de Nutcracker;
ANÁLISE:
O estudo inclui a avaliação da aorta, de toda a extensão (ou da maior parte possível) das AR e das artérias segmentares intrarrenais.
A aorta é analisada sobretudo junto à emergência das artérias renais, onde é avaliada a velocidade de pico sistólico (VPS), além de serem pesquisadas placas ateromatosas e outras eventuais patologias (aneurisma, dissecção, p.e.).
A avaliação das AR (figura abaixo) inclui a pesquisa de placas, estenoses, dissecções e aneurismas; ao Doppler, avalia-se o padrão de fluxo, os índices de resistividade (IR) e de pulsatilidade (IP), as VPS em seus diferentes segmentos, o tempo de aceleração sistólica inicial e o índice de aceleração.
Os principais parâmetros analisados nas artérias segmentares intrarrenais são o padrão de fluxo ao Doppler pulsado e as VPS.

A. Corte axial do abdome utilizando Doppler colorido demonstrando todo o trajeto de uma artéria renal direita normal desde sua emergência (seta). B. Avaliação com Doppler colorido e espectral da artéria renal direita (ARD) demonstra curva espectral e velocidades normais (VPS de 99,2 cm/s).
As artérias renais principais e segmentares tem, normalmente, baixos IR e IP, e tem aceleração elevada.
CONCEITOS TÉCNICOS:
A avaliação é realizada na posição supina ou em decúbito lateral, utilizando transdutor linear ou convexo com faixas de frequências baixas, entre 2,5 e 5 MHz. Preferencialmente, o estudo é realizado pela manhã e após jejum, com o objetivo de reduzir a quantidade de gás intestinal e assegurar que o estômago esteja vazio no momento do exame. Outras medidas podem ser empregadas com o mesmo propósito, como a administração de laxativos por exemplo.
LIMITAÇÕES:
Obesidade, incapacidade de manter apneia prolongada e gás intestinal em grande quantidade dificultam a avaliação das AR, as quais são adequadamente avaliadas em cerca de 70 a 90% dos exames. Quando a análise das AR é impossibilitada, podem ser utilizados sinais indiretos de estenose observados na vascularização intrarrenal, com índice de sensibilidade que varia entre 60-90%.
INTERPRETAÇÃO DOS RESULTADOS:
As artérias renais e segmentares apresentam, normalmente, fluxo de baixa resistência, com baixos IR e IP, além de aceleração sistólica inicial (ASi) elevada. Doenças renais intrínsecas (p.e. HAS, DM ou nefrosclerose) podem causar aumento do IR nas AR, mesmo com função renal preservada, atuando por vezes como fatores confundidores.
- Estenose de artérias renais:
A doença renovascular é uma desordem complexa, que tem como principais causas a displasia fibromuscular e a aterosclerose. Pode se apresentar sob três formas: estenose da AR assintomática, hipertensão renovascular ou nefropatia isquêmica. A importância do diagnóstico precoce baseia-se no fato de a doença renovascular sem tratamento estar associada à perda gradual e silenciosa da função renal. É uma causa potencialmente reversível de hipertensão secundária e insuficiência renal. A US Doppler das AR pode ser utilizada para o rastreamento da doença renovascular, identificando pacientes que necessitam de testes diagnósticos definitivos, como TC, RM ou arteriografia.
Os critérios para definição de estenose de artérias renais podem ser subdivididos em critérios diretos (no nível da estenose) e indiretos (observados na vasculatura intrarrenal) e estão resumidos na tabela abaixo. A maior parte dos autores recomenda o uso da combinação de ambos, o que resulta em sensibilidade e especificidade de cerca de 89% e 92%, respectivamente.
Critérios ao Doppler sugestivos de estenose hemodinamicamente significativa das artérias renais.
| CRITÉRIOS AO DOPPLER PARA ESTENOSE SIGNIFICATIVA (>60%) DAS ARTÉRIAS RENAIS |
| Critérios diretos (avaliação das artérias renais) |
| – Velocidade de pico sistólico (VPS) > 150 – 200 cm/s |
| – Relação entre VPS na artéria renal / VPS na aorta (RAR) > 3 |
| – Turbulência pós-estenótica |
| Critérios indiretos (inclui avaliação das artérias intrarrenais) |
| – Fluxo com padrão tardus parvus |
| – Relação entre VPS na artéria renal / VPS em artéria segmentar > 5 |
| – Índice de aceleração < 300 cm/s² |
| – Tempo de aceleração sistólica inicial > 0,08 s |
| – Ausência de pico sistólico inicial |
O critério direto mais importante é a VPS na AR (figura abaixo), cujo valor de corte para caracterização de estenose varia entre 150 e 200 cm/s na literatura. A relação entre as VPS na AR e na aorta abdominal suprarrenal (RAR) é um parâmetro mais confiável, sobretudo em pacientes com HAS que apresentam frequentemente velocidades de fluxo arterial globalmente aumentadas. Na presença de VPS < 40 cm/s na aorta, a RAR não pode ser empregada.

Estenose na emergência da artéria renal esquerda (ARE). Ao Doppler colorido (esquerda) já é possível observar turbilhonamento do fluxo na emergência da ARE, caracterizado por heterogeneidade da cor demonstrada na imagem (seta). A análise com Doppler espectral demonstra VPS de 261 cm/s, compatível com estenose hemodinamicamente significativa.
A repercussão da estenose pode ser identificada na circulação intrarrenal, na forma de fluxo de baixas velocidade e amplitude, por vezes com padrão tardus parvus, o qual tem alta especificidade para estenose da AR. Tardus significa lento e tardio, referindo-se ao tempo de aceleração sistólica prolongado; parvus significa pequeno, relacionado às baixas amplitude e VPS. Os critérios indiretos são particularmente úteis quando a avaliação adequada de toda a extensão das artérias renais não é tecnicamente possível.
O índice de resistividade (IR) nas AR pode ainda ser útil na predição de resposta à revascularização. Radermacher e colaboradores demonstraram que em pacientes com estenose, um IR ≥ 0,8 na AR implica em ausência de melhora da função renal ou da pressão arterial após o procedimento. Entretanto, estudo subsequente de Garcia-Criado et al chegou a resultados distintos, demonstrando melhora na função renal em 29% e da pressão arterial em 50% desses pacientes.
Lembrar que o Doppler de artérias renais é um exame de rastreamento; o diagnostico definitivo é pela angiotomografia ou angiografia.
- Avaliação pós-operatória de stents:
A taxa de re-estenose varia entre 2 e 36% em estudos de seguimento de 6 a 12 meses após a inserção do stent. Os principais parâmetros utilizados são a VPS no interior do stent e a RAR, com diferentes sensibilidades (S) e especificidades (E) dependendo dos valores de referência utilizados. Girndt e colaboradores utilizaram como valores de corte para definição de re-estenose VPS > 180 cm/s (S 100% / E 74%) e RAR > 3,5 (S 50% / E 89%). Já Bakker et ai empregaram como valores de referência a VPS > 226 cm/s (S 100% / E 90%) e a RAR > 2,7 (S 100% / E 84%).
- Aneurismas e dissecção:
Aneurismas isolados das AR são incomuns. A US Doppler geralmente consegue demonstrar a relação entre os óstios das AR e aneurismas e dissecções da aorta abdominal, identificando também eventual extensão para as mesmas.
No tocante à dissecção aórtica, pode haver fluxo nos lúmens verdadeiro e falso, e o curso da dissecção é frequentemente em espiral; consequentemente, cada AR pode ser suprida por um destes lumens. A avaliação de comprometimento do fluxo para as AR é de extrema valia nestes casos, com o objetivo de identificar se há risco de isquemia renal, o que pode influenciar na indicação de revascularização.
Artérias renais acessórias (variantes anatômicas) podem não ser identificadas em alguns casos.
- Patologias das veias renais:
A US Doppler está também indicada para avaliação de patologias das veias renais, como a pesquisa de trombose e o diagnóstico da Síndrome de Nutcracker, na qual há dilatação e hipertensão na veia renal esquerda devido à sua compressão entre a aorta e a artéria mesentérica superior.
DICAS E OBSERVAÇÕES:
Sugestão de protocolo / sequência para o exame:
- Via anterior:
- Análise da aorta
- Análise das porções proximais das artérias renais
- Via lateral (paciente de lado ou em DDH):
- Análise dos terços médios e distais das artérias renais
- Análise das artérias segmentares (aceleração)
Se houver muita interposição gasosa, pode-se virar o paciente para decúbito lateral e, em seguida, retorná-lo para DDH para ver se melhora.
Bexiga cheia pode ser responsável pelo aumento da impedância intrarrenal, principalmente no rim transplantado. Caso a bexiga esteja muito cheia, solicitar ao paciente que esvazie a bexiga.
Preparo intestinal não é obrigatório, contudo se houver interposição gasosa acentuada, remarcar com preparo. Alguns centros de radiologia preferem padronizar o preparo intestinal para todos.
Se não for possível observar a artéria renal, mesmo com preparo bom, mencionar no laudo. Mas, neste caso, será obrigatória a avaliação de achados indiretos, como a avaliação das artérias renais segmentares.
Lembrar que pode haver artérias renais acessórias que podem apresentar estenoses.
Avaliar malformações vasculares (FAV e aneurismas), infarto renal, trombose / embolismo e dissecções.
Se um dos rins do doador tiver alguma alteração menor (cicatriz, cisto simples ou cálice anormal) este deve ser o doado. Caso não haja diferenças, os
cirurgiões preferem o esquerdo. Preferível remover rim com artéria única (20% dos doadores têm múltiplas artérias renais).
Contraindicações para doar o rim:
- múltiplos cistos renais;
- 3 ou mais artérias renais;
- rim em ferradura;
- calculose renal extensa.
TÉCNICA DO EXAME:
Avaliação pelo Modo B: pesquisa de coleções, dilatação sistema coletor, tamanho do rim, etc.
Mapeamento vascular do enxerto com Doppler: avaliar com Power Doppler que aumenta a sensibilidade para detectar eventuais áreas pouco ou não
perfundidas. Ir aumentando gradualmente o PRF do Doppler com box incluindo todo a extensão longitudinal do rim, com o objetivo de pesquisar fístulas arteriovenosas (que terão fluxo com maior velocidade).
Avaliação arterial:
- Avaliar velocidade sistólica (VPS) na artéria ilíaca onde foi feita a anastomose
- Avaliar velocidade sistólica (VPS) na anastomose. Pode haver edema na parede arterial no pós-operatório imediato, causando aumento de velocidade na anastomose
- Avaliar índices de resistividade (IR) em ramos arteriais intrarrenais
Avaliação venosa:
- Avaliar a anastomose venosa, pesquisando estenose
ACHADOS ESPERADOS:
- Rim transplantado com dimensões aumentadas
- Espessura do parênquima renal aumentada
- Ecogenicidade aumentada da cortical do rim transplantado
- Ecogenicidade reduzida da medular (pirâmides)
- Complexo ecogênico central reduzido
- Aumento da impedância vascular
ALTERAÇÕES / COMPLICAÇÕES:
Complicações clínicas:
- Rejeição hiperaguda (0-72h), acelerada (3-7 d), aguda ( 7-28 d), crônica (+ 4 sem).
- Rejeição aguda é reversível. Lesão vascular endotelial. A impedância vascular Aumenta (IR > 0,75 e IP > 1,5).
- Rejeição crônica é irreversível. Há obliteração vascular e glomeruloesclerose.
- NTA. Mesma coisa q rejeição – aumenta impedância vascular (mesmos valores de referência).
- Nefrotoxicidade à ciclosporina
Complicações cirúrgicas:
- Coleções (topografia, ecogenicidade, tempo de PO, dimensões)
- Precoces: hematomas, seromas, urinomas
- Tardias: abscesso, linfoceles (4-8 sem)
- Urológicas
- Fistulas urinarias
- Estenose do ureter
- Obstrução : litíase, coágulos, bola de fungos;
- Vasculares:
- Precoces:
- Edema da anastomose: aumento de velocidade na anastomose no PO imediato; transitório (resolução espontânea).
- Oclusão da artéria renal : emergência cirúrgica. Rim aumentado e hipoecogênico. Ausência de fluxo intrarrenal (arterial e venoso). Artéria renal com curva de velocidade em espícula
- Trombose veia renal: emergência cirúrgica. Rim aumentado e hipoecogênico. Ausência de fluxo venoso. Impedância vascular elevada. Artéria renal com diástole reversa (em plateau)
- Tardias:
- Fístula arteriovenosa: costuma ter resolução espontânea, pode ter sido causada pela biópsia; área focal em mosaico, velocidades sistólica e diastólica aumentadas, fluxo venoso pulsátil; pseudoaneurisma (sinal yin-yang), estenose artéria renal (VPS > 250 cm/s +- 50 cm/s / aceleração em artéria segmentar > 3 / TAS <= 0,07 s).
- Precoces:
VALORES DE REFERÊNCIA:
- Velocidade de pico sistólico na artéria renal: até 200-300 cm/s
- Aceleração sistólica nas artérias segmentares: ≥ 3,0 m/s²
- IR ≤ 0,7
- IP ≤ 1,5
DICAS E OBSERVAÇÕES:
Sempre colocar no laudo se houve algo que atrapalhou o exame.
Ideal tempo de isquemia fria menor do que 12 h (máximo de 48-60h).
Anastomose venosa em adultos é feita na ilíaca externa ou comum. Em crianças, na ilíaca comum ou na veia cava inferior. Isso quando o rim
transplantado for colocado na fossa ilíaca.
Anastomose arterial em adultos: ilíaca interna, externa ou comum (mais na externa). Em crianças: aorta ou ilíaca comum
Necrose tubular aguda é reversível. Necrose cortical não.
Em rins de doadores cadáveres, é mais comum a ocorrência de NTA e, portanto, no PO imediato, será mais frequente encontrar valores de IR e IP
aumentados na vascularização intrarrenal (deve-se relatar isso e sugerir controle evolutivo). Entretanto, nestes mesmos pacientes que recebem rins de
doadores cadáveres, é menos comum (não é esperado) a observação de velocidades altas nas anastomoses arterial e venosa, pois são usados
patches retirados da veia cava inferior e da aorta do doador.
Já em rins de doadores vivos, não é comum a observação de IR e IP aumentados, pois não é esperada a ocorrência de NTA. Ao mesmo tempo,
podem ser encontradas velocidades mais altas nas anastomoses arterial e venosa (estes vasos ficam mais “esticados”) nestes casos.
A isquemia mesentérica pode ser dividida em quatro tipos: isquemia mesentérica crônica, doença oclusiva arterial aguda, trombose venosa mesentérica e insuficiência arterial mesentérica não obstrutiva. Dessa forma, a fisiopatologia pode ter base arterial, venosa ou estar relacionada a distúrbio sistêmico. A avaliação através da US Doppler de pequenos ramos vasculares, tanto arteriais quanto venosos, é bastante limitada e, por vezes, até impossível. Dessa forma, o método tem um papel limitado na isquemia mesentérica, restringindo-se ao estudo das porções proximais do tronco celíaco (TC), das artérias mesentérica superior (AMS) e inferior (AMI), e das veias mesentérica superior e porta. Entretanto, sua indicação nesta avaliação é válida em alguns casos, pois trata-se de um método inócuo, isento de radiação e que permite avaliação dinâmica, o que pode ser importante em algumas condições, como a compressão do tronco celíaco pelo ligamento arqueado do diafragma.
Outras indicações para o estudo da circulação esplâncnica são a pesquisa de (pseudo)aneurismas e a avaliação pós-operatória de endopróteses, por exemplo.
INDICAÇÕES:
- Investigação de isquemia mesentérica;
- Pesquisa de aneurismas e pseudoaneurismas;
- Avaliação pós-operatória de endopróteses.
ANÁLISE:
O estudo inclui a avaliação da aorta, dos óstios e dos segmentos proximais do TC, da AMS e da AMI.
Inicialmente, através do modo B são pesquisadas placas, tromboses, dissecções e aneurismas. Segue-se o estudo com Doppler colorido, para identificação de fluxo turbilhonado (indicativo de estenose) e de falhas de enchimento. Através do Doppler pulsado, são obtidas as velocidades de pico sistólico (VPS) na aorta, nas emergências porções proximais do TC, da AMS e da AMI e, caso sejam observadas áreas de estreitamento luminal suspeitas para estenoses, também se avalia as VPS antes e após cada estreitamento. Na suspeita da síndrome do ligamento arqueado mediano deve ser realizada a medida da VPS no tronco celíaco, em repouso, durante a inspiração e na expiração.
CONCEITOS TÉCNICOS:
A avaliação é realizada com o paciente na posição supina, utilizando transdutor convexo com faixas de frequências baixas, entre 2,5 e 5 MHz. Preferencialmente, o paciente deve estar em jejum, visando reduzir a interferência do excesso de gás intestinal e da peristalse exacerbada que ocorrem no estado pós-prandial. Outras medidas podem ser adotadas, como o emprego de soluções catárticas, dietas líquidas, e/ou o uso de laxativos.
LIMITAÇÕES:
Os ramos mesentéricos distais são de avaliação limitada à US Doppler. Para tal propósito, métodos axiais (TC ou RM) ou a angiografia estão indicados. Meteorismo e/ou jejum inadequado podem prejudicar ou até mesmo impossibilitar a realização do estudo, pois a interposição gasosa impede a passagem do feixe sonoro utilizado para a geração das imagens.
INTERPRETAÇÃO DOS RESULTADOS:
Não existe um consenso na literatura quanto aos critérios para a definição de estenose nestes segmentos arteriais, entretanto os mais utilizados se baseiam em valores absolutos de VPS (tabela abaixo). A relação entre as VPS na aorta e nas demais artérias é um critério menos empregado, contudo importante nas situações em que a velocidade na aorta apresenta-se mais alta ou mais baixa que o habitual, como em pacientes com baixo débito cardíaco ou em alguns casos de HAS, respectivamente, por exemplo. Nestes casos, uma relação entre a VPS na artéria avaliada (TC, AMS ou AMI) e a VPS na aorta maior que 3,0 a 3,5 é considerada suspeita para estenose significativa.
| CRITÉRIOS PARA ESTENOSE HEMODINAMICAMENTE SIGNIFICATIVA NAS ARTÉRIAS ESPLÂNCNICAS | |
| Artéria | Velocidade de pico sistólico (VPS) |
| Tronco celíaco (TC) | VPS ≥ 200 cm/s |
| Artéria mesentérica superior (AMS) | VPS ≥ 275 cm/s (estenose ≥ 70%) |
| Artéria mesentérica inferior (AMI) | VPS ≥ 200 cm/s (estenose ≥ 70%) |

Estenose na emergência da artéria mesentérica superior (AMS). Ao modo B (esquerda), observa-se acentuado estreitamento na emergência da AMS, suspeito de estenose significativa. A análise com Doppler espectral evidencia VPS de 393 cm/s na região do estreitamento, compatível com estenose hemodinamicamente significativa.
TIREOIDE
TÉCNICA DO EXAME:
- Documentar modo B da tireoide, com medidas dos lobos, istmo e volume total (normal de 6 a 15 cm³)
- Documentar nódulos, dando medidas nos três planos, com volume, indicando nas fotos qual das medidas é o diâmetro transverso e a localização do nódulo; avaliar ecogenicidade/ecotextura, presença de calcificações, presença de halo e IR e padrão de vascularização (Chammas)
- Registrar pelo menos os 4 maiores nódulos, todavia se houve mais nódulos hipoecogênicos, avaliar e registrar todos eles (mesmo se houver mais de quatro)
- Doppler dos nódulos: escala de PRF no primeiro número abaixo de 5; “estourar” o ganho e ir abaixando até reduzir o aliasing; avaliar vascularização
periférica e central dos nódulos, e determinar qual delas predomina; registrar o Doppler espectral de pelo menos um vaso central e dois periféricos (se não houver central, três periféricos), medindo o IR. Somar três IR de cada nódulo e fazer uma média. - Avaliar a vascularização do parênquima como um todo. É normal vascularização um pouco mais intensa nos pólos e menos no centro dos lobos. É
feita uma classificação da vascularização em: normal, pouco aumentada, aumentada e muito aumentada. - Documentar velocidades nas artérias tireoideas inferiores (procurar na região posterior dos lobos tireoideanos). Velocidades normais em torno de 15
a 30 cm/s. Em quadros inflamatórios (tireoidites), geralmente ultrapassa 30-35 cm/s. - Pesquisar linfonodomegalias, documentar os níveis.
- Dica: evitar usar o virtual convex do transdutor linear para medir, pois pode causar erro nas medidas.
VALORES DE REFERÊNCIA:
Velocidade na artéria tireoidea inferior: entre 15-30 cm/s
Classificação de Chammas:
- Padrão I: sem vascularização
- Padrão II: vascularização periférica
- Padrão III: vascularização periférica> central
- Padrão IV: vascularização central> periférica
- Padrão V: vascularização central
| Nódulos com risco aumentado de pertencer aos grupos citológicos de risco | ||||
| Ecogenicidade | Padrão de vascularização | Nódulos com diâmetro transverso < 1,0 cm | Nódulos com diâmetro transverso entre 1,1 e 2,0 cm | Nódulos com diâmetro transverso > 2,0 cm |
| Hipocogênico | IV/V | Qualquer IR | Qualquer IR | Qualquer IR ou padrão de vascularização |
| Hipocogênico | II/III | IR > 0,68 | IR > 0,5 | Qualquer IR ou padrão de vascularização |
| Não hipoecogênico | IV/V | IR > 0,82 | IR > 0,65 | IR > 0,4 |
| Não hipoecogênico | II/III | Baixo risco | IR > 0,96 | IR > 0,78 |
DOPPLER ESCROTAL E PENIANO
INFORMAÇÕES GERAIS:
A varicocele envolve dilatação anormal das veias no plexo pampiniforme do cordão espermático e é relativamente comum. A maioria dos casos é idiopática; as varicoceles são encontradas principalmente em adolescentes e adultos jovens e são mais frequentes no lado esquerdo. Na ultrassonografia, as veias dilatadas aparecem como estruturas tubulares tortuosas, anecoicas, ao longo do cordão espermático. Em imagens de Doppler colorido e de onda pulsada, o fluxo venoso é melhor demonstrado durante a manobra de Valsalva. A varicocele pode afetar o crescimento testicular; portanto, os volumes dos testículos devem ser avaliados sistematicamente para pesquisar por assimetrias.
VALORES DE REFERÊNCIA:
Vascularização:
- Velocidade de pico sistólico > 15 cm/s: sugestivo de orquiepididimite
- IR < 0,5: sugestivo de orquiepididimite
- Refluxo maior do que 1,0 seg nos vasos do plexo pampiniforme (em ortostase): sugestivo de varicocele
Diâmetro dos vasos do plexo pampiniforme > 2 mm: sugestivo de varicocele.

INDICAÇÕES:
- Investigação de causas orgânicas para disfunção erétil
- Priapismo
- Doença de Peyronie
ANATOMIA PENIANA:

O corpo peniano consiste em dois corpos cavernosos emparelhados, que são os principais corpos eréteis, e o corpo esponjoso, que contém a uretra (figura abaixo). A túnica Dartos externa e a fáscia de Buck interna contêm a veia dorsal profunda e o feixe neurovascular dorsal. A túnica albugínea (TA) também possui duas camadas: uma camada externa de fibras longitudinais e uma camada interna de fibras circulares com pilares perpendiculares, que servem para aumentar o suporte fornecido pelo septo intracavernoso. A porção interna dos corpos consiste em sinusoides interconectados separados por trabéculas do músculo liso. O corpo esponjoso não possui a camada longitudinal externa, nem estruturas de suporte.

Modo B, corte transverso por via dorsal do terço médio do pênis mostrando: os corpos cavernosos (CC) contendo as respectivas artérias cavernosas (setas); o corpo esponjoso (CS) contendo a uretra (^); o septo peniano (*); a túnica albuginea aparece como uma fina linha ecogênica ao redor dos corpos penianos (cabeça de seta sólida). A fáscia de Buck (seta aberta) é identificada próximo do corpo esponjoso (CS), estando suas demais porções aderidas à túnica albugínea.

Modo B, corte longitudinal do aspecto ventral da glande evidencia o ligamento peniano distal (setas) como uma estruturas linear sólida e ecogênica situada centralmente dentro da glande, tendo a função de suporte. Glans: glande; CC: corpo cavernoso.
A principal fonte de suprimento sanguíneo para o pênis é geralmente através da artéria pudenda interna, que se origina da divisão anterior da artéria ilíaca interna. A artéria pudenda interna torna-se a artéria peniana comum após a emergência de um ramo para o períneo. Os ramos da artéria peniana são a artéria dorsal, a artéria bulbouretral e a artéria cavernosa (AC). A AC é responsável pela tumescência do corpo cavernoso e a artéria dorsal é responsável pelo ingurgitamento da glande do pênis durante a ereção. Distalmente, três ramos das artérias penianas se unem para formar um anel vascular, como uma anastomose, próximo à glande. A AC dá origem a muitas artérias helicíneas, que suprem o tecido erétil trabecular e os sinusoides (figura abaixo). As artérias helicíneas permanecem contraídas e tortuosas quando o pênis está flácido, e tornam-se dilatadas e retas durante a ereção.

Suprimento arterial peniano relacionado à ereção: principais artérias e ramos.

Velocidade de pico sistólico (VPS) na artéria cavernosa ao Doppler. A VPS deve ser medida consistentemente na junção do terço proximal e dos dois terços distais da haste peniana (seta) onde a artéria cavernosa se curva.
A drenagem venosa dos três corpos se origina nas minúsculas vênulas logo abaixo da túnica albugínea, formando o plexo venular sub-túnico antes de emergir como veias emissárias. Fora do túnica albugínea, uma proeminente veia dorsal profunda é a principal via de drenagem venosa via veia circunflexa. Então, uma única veia dorsal profunda tem curso cranial por trás da sínfise púbica, para se juntar ao plexo venoso periprostático.

Drenagem venosa peniana: veias superficiais, profundas e plexo venoso subtunical relacionado ao mecanismo de veno-oclusão.
Durante a ereção, há o relaxamento do músculo liso das arteríolas e dos corpos cavernosos, possibilitando um aumento substancial do fluxo sanguíneo, com rápido enchimento e dilatação dos sinusoides contra a túnica albugínea. Dessa forma, os plexos venulares sub-túnicos são comprimidos, resultando em oclusão quase completa do fluxo venoso. Com isso, o sangue fica preso na cavernosa, aumentando a pressão intracavernosa até a ereção completa. Durante a atividade sexual, o músculo isquiocavernoso comprime a base do corpo cavernoso e, na fase de ereção rígida, cessam temporariamente a entrada e saída de sangue. A detumescência se inicia com a contração do músculo liso trabecular e a abertura do canal venoso, expulsando o sangue aprisionado e restaurando a flacidez.

Alterações anatômicas nos corpos cavernosos durante a ereção: enchimento dos sinusoides e compressão das veias subtunicais.

Mecanismo de veno-oclusão: expansão do músculo liso trabecular dos corpos cavernosos gerando compressão das veias subtunicais e redução da drenagem sanguínea.
CONCEITOS TÉCNICOS:
A ultrassonografia peniana deve ser realizada com transdutor linear de alta frequência, com o paciente em decúbito dorsal. É um exame que requer maior privacidade do que o habitual, em ambiente privado. O pênis é escaneado de sua superfície ventral nos eixos longitudinal e transversal.
A avaliação deve ser realizada com o pênis flácido e após a injeção intravenosa de drogas vasoativas. A avaliação com Doppler espectral deve ser realizada com ajuste para fluxo lento.
Diversos agentes farmacológicos podem ser utilizados para a injeção intracavernosa, tais como papaverina, fentolamina, prostaglandina E1 e alprostadil. Sugestão de medicação: Alprostadil 20 mcg, injetado em um dos corpos cavernosos do pênis. Deve-se injetar no aspecto lateral do eixo médio do pênis, após avaliação do estado flácido.

Tecnica de aplicação da droga vasoativa: com uma das mãos estica-se o pênis e com a outra mão aplica-se a injeção na lateral do pênis, evitando a linha mediana, onde passam as estruturas neurovasculares.

Tecnica de aplicação da droga vasoativa: aplica-se a injeção na lateral do pênis, evitando a linha mediana, onde passam as estruturas neurovasculares.
Existe a possibilidade de complicações após a injeção de drogas vasoativas, tais como priapismo (ereção com duração maior que 4 horas), hipotensão, dor e hematoma, o que deve ser explicado ao paciente antes da injeção. Caso o paciente apresente ereção prolongada e dolorosa (EPD) (> 1 hora de duração), deve-se estar preparado para tratar tal complicação: monitorização (PA, pulso e saturação de oxigênio) e administração intracavernosa de lidocaína (20 mg/mL 2%) + adrenalina (0,005 mg/mL) diluída (2 mL da solução decimal a cada 5 minutos) até a detumescência peniana. Em caso de resposta insatisfatória a essa medida, sugere-se encaminhar à avaliação de urgência por Urologista (pronto-socorro / pronto atendimento).
Uma opção para reduzir a quantidade de falsos-positivos para diagnóstico de disfunção erétil, é a utilização de “estímulo sexual manual e audiovisual” (EMAV), em que após a injeção da droga vasoativa, os pacientes são orientados a se estimularem sexualmente por meio de masturbação, enquanto assistem a um filme erótico com 4 minutos de duração, sozinhos na sala de exame; caso seja optado por utilizar o EMAV deve-se orientar os pacientes a não ejacularem e a cessarem a estimulação caso houver a sensação pré-orgásmica.
No estado flácido, os corpos penianos apresentam ecogenicidade intermediária e ecotextura homogênea. Após a injeção cavernosa, a distensão sinusoidal começa na porção central da cavernosa, que parece menos ecogênica que a porção externa. Durante a fase de enchimento, é possível identificar a fina rede ecogênica no corpo cavernoso devido a inúmeras interfaces com os sinusoides dilatados (figura abaixo). O septo peniano aparece como uma estrutura ecogênica com atenuação das costas, o que pode dificultar a avaliação do aspecto dorsal do pênis e da túnica albugínea.

Modo B, corte transverso do pênis por via ventral, mostrando o aspecto normal dos corpos penianos com o pênis flácido, com ecogenicidade intermediária e ecotextura homogênea.

Modo B, corte transverso do pênis por via ventral, mostrando o aspecto normal dos corpos penianos alguns minutos após a injeção intracavernosa, com início da dilatação dos sinusoides nas porções centrais dos corpos cavernosos.

Modo B, corte transverso do pênis por via ventral, mostrando o aspecto normal dos corpos penianos com o pênis em ereção completa, com numerosos sinusoides dilatados envoltos por uma rede ecogênica fina nos corpos cavernosos.

Modo B. Na fase de enchimento, corte transverso do pênis evidencia um pilar intracavernoso (cabeça de seta), caracterizado por uma linha ecogênica espessa se dirigindo do aspecto lateral ao medial da túnica albugínea. Desempenha papel de suporte do corpo cavernoso. Geralmente, desaparece durante a ereção completa. Observe que o septo peniano (*) demonstra sombra acústica posterior.
A velocidade de pico sistólico (VPS) da artéria cavernosa varia significativamente de acordo com o local e o ângulo de amostragem. A fim de padronizar as medições de velocidade, a amostragem espectral é obtida na origem, na base do pênis, sob a orientação do sinal Doppler colorido, onde a artéria cavernosa se inclina posteriormente em direção ao crus. As figuras abaixo mostram as variações normais de onda na artéria cavernosa durante a ereção.

Curvas espectrais normais da artéria cavernosa durante a ereção. Fases: flácida (A), de enchimento (B), tumescente (C), ereção completa (D) e ereção rígida (E). Na fase flácida, as formas de onda monofásicas denotam fluxo de baixa velocidade e alta resistência (apenas sístole sem diástole). Após o início da ereção, há aumento da sístole e diástole, correspondendo ao início da fase de preenchimento. Quando a pressão intracavernosa começa a subir, surge um entalhe no final da sístole e observa-se redução progressiva da diástole. Quando a pressão intracavernosa se iguala à pressão diastólica sistêmica, a velocidade diastólica final (VDF) desaparece. Então, a diástole é revertida devido ao aumento da pressão intracavernosa acima dela, refletindo a fase de ereção completa. Durante a ereção rígida, são observadas redução na VPS e desaparecimento da diástole. A fase de ereção rígida não é comumente observada após uma ereção induzida.
Uma curva tempo-velocidade pode ser usada para ilustrar as alterações hemodinâmicas nas diferentes fases eréteis. O período entre o ponto inicial da diminuição do fluxo diastólico e a diástole reversa indica o período em que o mecanismo veno-oclusivo está operando.
Como as artérias dorsais estão fora da túnica albugínea e, portanto, não estão sujeitas a alterações da pressão intracavernosa e à fase de ereção, elas mostram fluxo diastólico anterógrado persistente.
Dorsalmente, a veia dorsal pr0funda localizada na linha média não é consistentemente visível em indivíduos normais durante todas as fases da ereção, bem como na fase flácida. No entanto, pode ser identificada na detumescência. Uma veia dorsal profunda proeminente é comumente visualizado em disfunção erétil veno-oclusiva.
Resumo prático da técnica de exame:
Modo B:
– Avaliar a anatomia dos corpos cavernosos da base ao aspecto distal do pênis.
– Localizar as artérias cavernosas de ambos os corpos cavernosos em seu aspecto mais proximal, medindo seus diâmetros ANTES da injeção da droga vasoativa e APÓS 5 MINUTOS da injeção intracavernosa da droga vasoativa. Para essa medida, considerar somente seu lúmen, desconsiderando suas paredes.
Doppler:
– ANTES da injeção intracavernosa: medir a velocidade de pico sistólico (VPS) das artérias cavernosas.
– APÓS a injeção intracavernosa: medir a VPS, a velocidade diastólica final (VDF) e o índice de resistividade (IR) das artérias cavernosas, 5, 10, 15 e 20 minutos após a injeção.
Sugestão de medicação para injeção intracavernosa: Alprostadil 20 mcg.
Observação: como mencionado acima, pode-se utilizar também o “estímulo sexual manual e audiovisual” (EMAV) após a injeção intracavernosa de droga vasoativa, por 4 minutos.

Medida do diâmetro das artérias cavernosas antes e após a indução farmacológica.
INTERPRETAÇÃO DOS RESULTADOS:
- DISFUNÇÃO ERÉTIL:
A disfunção erétil (DE) pode ser psicogênica, orgânica (neurogênica, hormonal, vasculogênico ou induzido por drogas) ou misto. A DE mista é a mais comum e envolve um componente psicogênico e um componente orgânico.
A ultrassonografia com Doppler do pênis permite identificar e classificar o componente orgânico da DE, que pode ser ainda classificado como do tipo arterial ou venoso. O DE arteriogênica envolve comprometimento do influxo arterial no cavernoso devido a várias possíveis causas. Já no DE venogênica, há um mecanismo veno-oclusivo comprometido que causa vazamento venoso.
A VPS é o indicador mais preciso da doença arterial. A insuficiência arterial é diagnosticada quando a VPS é menor que 25 cm/s, com 92% de acurácia (alguns autores utilizam 30 cm/s como valor de referência).

Paciente com disfunção erétil arteriogênica, evidenciando velocidade de pico sistólico (VPS) menor do que 25 cm/s (alguns autores utilizam 30 cm/s como valor de referência)
A DE venogênica mostra uma VDF persistente maior do que 5 cm/s durante todas as fases da ereção, e o fluxo na veia dorsal profunda é visível ao Doppler durante todas as fases.

Paciente com disfunção erétil veno-oclusiva, evidenciando velocidade diastólica final (VDF) persistentemente acima de 5 cm/s durante todas as fases da ereção.

Paciente com disfunção erétil veno-oclusiva, evidenciando fluxo na veia dorsal profunda visível durante a fase de ereção completa.
O diagnóstico de DE mista não pode ser realizado com ultrassonografia Doppler, porque a competência venosa não pode ser avaliada em um paciente com insuficiência arterial. Na prática, a maioria dos pacientes idosos ou pós-operatórios de disfunção erétil apresenta essa forma indeterminada.
Antes de realizar o exame, é importante revisar as respostas do paciente a questionários e registros de eventos da função erétil, como o Índice Internacional de Função Erétil. Na prática, é utilizada uma versão simplificada e reduzida.
Os principais parâmetros do Doppler para diagnosticar DE são a VPS e a VDF. A mudança no diâmetro da artéria cavernosa e os sinais de fluxo da veia dorsal profunda, bem como o índice de resistência (IR) são parâmetros menores para diferenciar os tipos de DE.
Referência da normalidade:
– Aumento de pelo menos 75% no diâmetro das artérias cavernosas após a injeção da droga vasoativa
– VPS > 25-30 cm/s em pelo menos uma das artérias cavernosas
– VDF < 5 cm/s em pelo menos uma das artérias cavernosas – IR > 0,9 em pelo menos uma das artérias cavernosas
Disfunção erétil arteriogênica:
– VPS < 25-30 cm/s em ambas as artérias cavernosas (independente dos valores de VDF e IR)
Disfunção erétil venogênica:
– VPS > 25-30 cm/s, VDF > 5 cm/s e IR < 0,75 em ambas as artérias cavernosas.
| CRITÉRIOS DIAGNÓSTICOS E PARÂMETROS NO DOPPLER PENIANO | |
| Parâmetro ao Doppler | Critério Diagnóstico |
| Velocidade de pico sistólico (VPS) na artéria cavernosa
(critério maior) |
|
| Velocidade diastólica final (VDF) na artéria cavernosa
(critério maior) |
|
| Veia dorsal profunda |
|
| Complacência arterial da artéria cavernosa
(critério secundário) |
|
| Índice de resistência da artéria cavernosa
(critério secundário) |
|
- PRIAPISMO:
O priapismo é definido como ereção persistente não relacionada à estimulação sexual e pode ser classificado em tipos arterial e venoso.
O priapismo venoso ou isquêmico é mais comum que o tipo arterial e é uma emergência médica causada pela diminuição ou ausência da drenagem venosa; geralmente se apresenta com falta de fluxo sanguíneo ou padrão de fluxo de muito alta resistência na artéria cavernosa.

Doppler colorido, corte longitudinal do corpo cavernoso. Paciente com priapismo de baixo fluxo ou isquêmico, mostrando ausência de fluxo sanguíneo na artéria cavernosa.
O priapismo arterial ou de alto fluxo é secundário a um influxo arterial aumentado não controlado nos casos de fístula ou metástase cavernosa de um tumor sólido. A fístula arterial-lacunar no priapismo de alto fluxo causa um bypass nas artérias helicíneas, estendendo-se diretamente para o tecido cavernoso, sendo evidenciado à US-Doppler como um fluxo turbulento de alta velocidade.

Modo B (esquerda) e Doppler colorido (direita). Paciente com priapismo de alto fluxo devido a fístula arterial-lacunar que se estende diretamente para o tecido cavernoso e aparece como fluxo turbulento de alta velocidade e aliasing.
- DOENÇA DE PEYRONIE:
A doença de Peyronie é caracterizada por curvatura progressiva e encurtamento da haste peniana, e pode estar associada a um nódulo palpável, levando ao desenvolvimento de dor durante a ereção e dispareunia. A ultrassonografia do pênis no Modo B mostra nódulo(s) calcificados ao longo do envelope túnico cavernoso, que podem estar associados à disfunção erétil do tipo venogênica. Placas não calcificadas podem ser de difícil identificação pelo modo B, podendo ser de mais fácil caracterização por sonoelastografia.

Sonoelastografia em paciente com doença de Peyronie. A placa fibrosa não calcificada (*) no Modo B aparece com sinal proeminente de tecido rígido (cor vermelha no mapeamento por elastografia).
REFERÊNCIAS BILIOGRÁFICAS:
Carneiro, F. Avaliação do efeito do estímulo manual e audiovisual no estudo de ultrassonografia Doppler do pênis com fármaco-indução em pacientes com difunção erétil. 2019. Tese (Doutorado) – Faculdade de Medicina da Universidade de São Paulo, São Paulo – SP.
Jung DC, Park SY, Lee JY. Penile doppler ultrasonography revisited. Ultrasonography, v. 37, n. 1, p. 16–24, 2018.
DOPPLER TRANSVAGINAL E OBSTÉTRICO
PRINCIPAIS INDICAÇÕES:
- Desordens menstruais
- Infertilidade
- Sangramento pós-menopausa, na ausência de miomas. Diferenciação entre endométrio atrófico e outras patologias. Se somente endométrio atrófico, IR nas uterinas 0,85 +/- 0,08. Se houver outras patologias, 0,77 +/- 0,03. Na presença de
IR > 0,83, a probabilidade de Ca Endométrio é muito baixa. - Doença trofoblástica muda parâmetros de vascularização dentro do endométrio: aumenta VPS para 57,5 cm/s +/- 20,4 (normal: 28,3 +/- 3,41) e reduz IR para 0,56 +/- 0,19 (normal: 0,86 +/- 0,05)
- Gestação ectópica: a avaliação do Doppler do tecido trofoblástico na gestação ectópica permite diferenciar se ele está ativo (IR baixo) ou inativo (IR > 0,8), auxiliando a tomada de decisão (tratamento conservador ou cirúrgico)
- Tumores
- Torção ovariana: presença de fluxo não exclui
ANATOMIA:

Artérias ilíacas internas se bifurcam em dois ramos (anterior e posterior). O anterior situa-se posteriormente ao ovário e ao ureter, e emite outros ramos. Um destes ramos é a artéria uterina, que depois de cruzar acima do ureter chega ao útero com trajeto tortuoso junto ao aspecto lateral do útero, onde emite vários ramos uterinos. A artéria uterina é acompanhada em seu curso pela veia uterina.

Distribuição das artérias uterinas e ovarianas. Cada artéria uterina é um ramo da artéria ilíaca interna e ascende pela face lateral do útero; envia ramos para o ovário e para a tuba uterina. Os ovários também são supridos pelas artérias ovarianas (de cada lado).
Os ovários tem suprimento arterial duplo. Um deles é pela artéria ovariana, que é um ramo da artéria ovariana à esquerda e, geralmente, da aorta à direita. As artérias ovarianas tem trajeto posterior e medial aos ureteres em seus cursos até os ovários, cruzando os vasos ilíacos externos para entrar na pelve verdadeira, depois curvam-se medialmente no ligamento suspensório do ovário, chegando até o ligamento largo, onde seus ramos terminais suprem o ovário e se anastomosam aos ramos anexiais da artéria uterina.
TÉCNICA DO EXAME:
PRF entre 10-50 cm/s (é a VPS média nas artérias uterinas e ovarianas).
Artérias uterinas: examinadas ao longo dos aspectos laterais do corpo uterino. Seus ramos para os ovários podem ser observados no ligamento largo. Os valores de referência variam de acordo com fase do ciclo menstrual (tabela abaixo). Podem ser identificadas as artérias espiraladas também (ramos das uterinas, que cursam perpendicularmente às uterinas em direção ao endométrio).
Artérias ovarianas são identificadas no aspecto superior dos ovários. Os valores de IR variam de acordo com fase do ciclo (tabela abaixo). Em geral, valores normais são IR de 0,4 a 0,8, e valores de IP variam entre 0,6 e 2,5.
A identificação de fluxo nos ovários depende da fase do ciclo menstrual. Quanto mais perto da ovulação (e observação do corpo lúteo), maior será o fluxo.
As veias pélvicas tem diâmetro é extremamente variável, mas normalmente têm menos do que 0,5 cm de diâmetro e velocidades entre 5 e 10 cm/s. Diâmetro >0,5 cm e velocidades < 5 cm/s são anormais. Um fluxo reverso com velocidade > 2 cm/s durante manobra de Valsalva também é considerado alterado. Estas alterações podem indicar síndrome da congestão pélvica.
Quando o endométrio estiver espessado ou com pólipos, pode-se observar seu padrão de vascularização:
- Padrão de vaso único: pode sugerir pólipo
- Padrão de múltiplos vasos: pode ser hiperplasia ou carcinoma
- Padrão ” salpicado”: inespecífico
| VARIAÇÕES NOS ÍNDICES DE DOPPLER NAS ARTÉRIAS UTERINAS E OVARIANAS NO CICLO MENSTRUAL | ||||
| Fase do ciclo menstrual | Índice de Resistência (IR) nas artérias ovarianas | Índice de Pulsatilidade (IP) nas artérias ovarianas | Velocidade nas artérias ovarianas (cm/s) | Índice de Pulsatilidade (IP) nas artérias uterinas |
| Folicular precoce | 0,65 – 0,7 | 1,8 – 2,2 | 20 | 1,67 +/- 0,22 |
| Folicular tardia / ovulação | 0,55 – 0,6 | 1,0 – 1,3 | 40 | 1,89 +/- 0,4 |
| Lútea | 0,6 – 0,65 | 1,3 – 1,8 | 2,23 +/- 0,67 | |
| Não-concepção | 0,6 – 0,7 | 1,8 – 2,2 | 3,85 +/- 1,1 | |
| Pós-menopausa | 0,6 – 1,0 | 1,3 – 4,0 | 1,8 – 3,8 | |

A e B: US transabdominal sagital, em plano junto à margem esquerda do útero, evidenciando a artéria e veia uterinas. C e D: US transabdominal coronal mostrando as artérias uterinas e suas curvas espectrais.
CONCEITOS GERAIS:
- Feto PIG: quando não há patologia materna que justifique insuficiência placentária (DM / HAS) e o Doppler está normal
- Feto com RCIU: quando há patologia ou alteração no Doppler da ACM
Parâmetros do Doppler:
- Razão Sistólica/Diastólica = VPS / VDF
- IR = (VPS – VDF) / VPS
- IP = (VPS – VDF) / Velocidade média
VPS: velocidade de pico sistólico; VDF: velocidade diastólica final; IR: índice de resistência; IP: índice de pulsatilidade.
Impedância vascular (o que não é sinônimo de resistência), depende da resistência, da FC, da contratilidade cardíaca e da pré-carga.
Circulação fetal:
- Sangue rico em O2:
Placenta – veia umbilical – dois caminhos (através do fígado pelo ramo esquerdo da porta ou pelo ducto venoso diretamente para a veia cava inferior sem passar pelo fígado)
Veias hepáticas, VCI e ducto venoso se juntam num vestíbulo e drenam para o átrio direito. A maior parte do fluxo que chega ao átrio direito vai diretamente para o esquerdo pelo forame oval. Da parte que vai para o VD e daí para tronco da pulmonar, boa parte também é desviada através do ducto arterioso para a aorta (devido à alta pressão da circulação pulmonar).
- Sangue rico em CO2:
Chega ao átrio direito pela veia cava superior.
Há um esfíncter funcional que regula a abertura do ducto venoso (para regular a quantidade de sangue rico em O2 que será desviado do fígado diretamente para VCI). Com hipóxia crônica, uma maior quantidade de sangue é desviada para o ducto venoso (normalmente 60-70% do sangue passa pelo fígado; quando há este desvio, diminui essa proporção).
Uma vez que o sangue tem velocidade muito alta no ducto venoso (por ter calibre menor que as veias hepáticas), ele forma uma “corrente” de sangue (pela VCI, em sua porção à esquerda. junto com o sangue da veia hepática esquerda), com trajeto preferencial para o forame oval e átrio esquerdo.
Já o sangue com menor velocidade das veias hepáticas (particularmente as veias média e direita, já que o da esquerda drena junto com o do ducto venoso) acaba indo preferencialmente para o VD e circulação pulmonar (tem menos O2, pois já foi retirado no fígado).
Redistribuição do fluxo: aumento do IP na Artéria Umbilical (AU) e redução do IP na artéria cerebral média (ACM) = sugere aumento da resistência na AU e redução na ACM.
Análise das artérias uterinas e umbilicais: avaliação da função placentária
ARTÉRIAS UTERINAS:
Avaliar de cada lado do útero; colocar vasos ilíacos externos no longitudinal em sua porção mais distal, aí dará pra ver as artérias uterinas cruzando com eles e subindo em direção ao útero (deverão ser avaliadas logo após seu cruzamento com os vasos ilíacos).
Normalmente, após a metade do 2º trimetre, o fluxo passa a ter diástole cheia e contínua, demonstrando baixa resistência e alto fluxo diastólico. Quando há falha na invasão trofoblástica das artérias espiraladas, haverá alta resistência e redução da perfusão placentária.
Se houver ALTA RESISTÊNCIA ou INCISURA NO INÍCIO DA DIÁSTOLE = maior risco de RCIU.
Em casos graves, fluxo diastólico pode estar ausente (zero) ou até invertido.
Se aumento do IR = risco de RCIU
Se aumento do IP (>1,41 a partir do 2º tri) = risco de pré-eclampsia
Aumento do IR e IP (impedância nas uterinas) = Aumenta risco de pré-eclampsia, RCIU, parto cesárea de emergência, descolamento de placenta, prematuridade.
Se ambas as artérias uterinas tiverem IP normal, a;ta probabilidade (“99%”) que a paciente não desenvolverá pré-eclampsia ou RCIU

A: artéria uterina em seu trajeto cruzando os vasos ilíacos externos; quando parece que a artéria uterina se origina da artéria ilíaca externa, trata-se de um artefato; a artéria uterina (UTA) é avaliada logo após seu cruzamento com os vasos ilíacos (EIA: artéria ilíaca externa; EIV: veia ilíaca externa). B: O padrão espectral normal na UTA evidencia fluxo diastólico “cheio”. C: padrão espectral alterado na UTA, mostrando fluxo diastólico reduzido e incisura no início da diástole.
ARTÉRIA UMBILICAL
Pode avaliar em qualquer ponto dela, exceto se houver fluxo reverso, aí terá que avaliar próximo da inserção placentária, que é o ultimo ponto em que se desenvolve o fluxo reverso).
No 1º trimestre, é NORMAL que o fluxo diastólico seja ZERO. Com o avançar da gestação é esperado que o componente diastólico aumente (redução da resistência da vascularização placentária). Da metade do 2º tri para frente, é ANORMAL fluxo diastólico ausente ou reverso. Alguns fetos possuem fluxo diastólico reduzido normalmente durante toda a gestação, mas nunca ausente.
Há aumento da impedância na artéria umbilical somente quando >60% do leito placentário está obliterado.
Alteração no padrão de onda da artéria umbilical é sinal precoce de comprometimento fetal (precede alteração na cardiotocografia).

Doppler da artéria umbilical em um caso de oligodrâmnio, mostrando curva espectral normal na artéria umbilical.

Curvas espectrais na artéria umbilical com RCIU. Imagem da esquerda: RCIU com redução do fluxo diastólico. Imagem do meio: RCIU grave com ausência do fluxo diastólico final. Imagem da direita: fluxo diastólico reverso, denotando alto risco de morbi-mortalidade para o feto.

ARTÉRIA CEREBRAL MÉDIA
Com o avançar da gestação, aumenta o fluxo sanguíneo para o SNC, com redução do IP. No 1o tri, é normal que a diástole seja negativa. No 2o e 3o tri, o componente diastólico aumenta um pouco.
O IP na ACM é um pouco maior do que na ACI ou ACA ou ACP. Por isso, é importante avaliar a ACM mesmo e não outra, que terá outros valores de referência.
A ACM deve ser avaliada logo após sua emergência da ACI.
Valores baixos normais de IP no inicio e fim da gravidez podem ser causados por aumento das necessidades metabólicas do SNC, e isso pode ser normal.
Na RCIU / sofrimento fetal, há aumento do fluxo para o SNC, com redução do IP. Quando há redução do IP, há maior incidência de resultados perinatais adversos.
Além disso, a VPS (velocidade de pico sistólico) está AUMENTADA em pacientes com RCIU (outra coisa que pode aumentar a VPS na ACM é anemia). Uma anemia grave também pode causar centralização, por exemplo, por isoimunização materno-fetal.
Causas de baixo IP na ACM: estirão de crescimento cerebral, após contrações uterinas, alta FC fetal, anemia grave, pós-transfusão, amniocentese terapêutica, insuficiência tricúspide e constrição ductal, hipoxemia e acidemia.
Causas de alto IP na ACM: durante contrações uterinas, baixa FC fetal, oligodrâmnio, compressão da cabeça fetal, acidemia e hipoxemia persistentes, hidranencefalia, administração de indometacina.

A: Doppler colorido do círculo de Willis do feto. B: Doppler espectral normal de uma das artérias cerebrais médias, que devem ser avaliadas logo após sua emergência das artérias carótidas internas. IP de 1,6 e VPS de 37 cm/s.

Doppler espectral da ACM de feto com anemia, mostrando aumento da VPS para 72 cm/s.

Doppler espectral da ACM em caso de grave sofrimento fetal. Há marcado aumento no fluxo diastólico, refletindo a “centralização” do fluxo sanguíneo fetal, denotando isquemia.


DUCTO VENOSO
Papel importante no retorno venoso da placenta. É um shunt de sangue rico em O2 (40% fluxo da artéria umbilical) sem passar pelo fígado.
Anatomia: a veia umbilical entra no abdome e tem primeiro um trajeto cranial, depois mais horizontal e posterior; em seguida, faz uma curva para a direita e se une à parte transversa do ramo portal esquerdo. O ducto venoso se origina da veia umbilical intra-abdominal antes dessa curva pra direita. Tem um terço do calibre da veia umbilical e tem curso posterior e cranial, e entra na veia cava inferior imediatamente abaixo do diafragma (as 3 veias hepáticas entram na veia cava no mesmo ponto).
Melhor jeito de encontrar o ducto venoso pela ultrassonografia: CORTE MÉDIO-SAGITAL.
O ducto venoso não deve ser avaliado tão perto da entrada na VCI.
Ondas de velocidade de fluxo do ducto venoso são caracterizadas por um pico sistólico, um diastólico e um “nadir” durante a contração atrial, sem componente de fluxo reverso após.
Variantes normais: padrão de onda com pouca ou nenhuma variação (3%).
Um aumento da pressão diastólica final ventricular causa aumento da velocidade de fluxo venoso para o coração na contração atrial = a onda que corresponde ao nadir (ultima) ficará com menor amplitude ou até negativa.
Há 2 mecanismos que causam onda de contração atrial reduzida / zero ou negativa:
- Aumento pós-carga cardíaca (ler abaixo em centralização)
- Falência cardíaca: neste caso, ao invés de um padrão de grande pulsatilidade (aumento onda sistólica e diastólica, com redução da onda contração
atrial), haverá um padrão de baixa variabilidade / pulsatilidade, que significa que o miocárdio está comprometido. A sístole e diástole não influem muito
na onda. Apesar de ambos os padrões terem prognostico ruim, este tem ainda pior, porque reflete falência da bomba cardíaca.

Doppler colorido. Corte oblíquo do abdome fetal demonstrando o local do ducto venoso, identificado pelo fluxo turbilhonado com aliasing, onde ele deve ser avaliado.

Padrão espectral normal no ducto venoso

Padrões de doppler espectral no ducto venoso. Imagem da esquerda: padrão normal. Segunda imagem: redução do fluxo da onda A. Terceira imagem: fluxo ausente na onda A. Última imagem: onda A reversa

Padrões de fluxo espectral no ducto venoso em fetos de 12 semanas. A: padrão espectral normal, com onda A positiva. B: onda A reversa. C: contaminação da amostra pela artéria umbilical, que pode levar a um falso diagnóstico de onda A positiva. D: contaminação da amostra pela artéria hepática, que pode levar a um falto diagnóstico de onda A reversa.
CENTRALIZAÇÃO
A redistribuição de fluxo ocorre para o SNC, miocárdio e adrenais, com redução do fluxo para rins, TGI e membros inferiores. Para que isso ocorra, a vasodilatação
cerebral é insuficiente. Quando há sofrimento fetal / hipoxemia / tentativa de centralização, há aumento do fluxo pelo ducto venoso (para desviar fluxo oxigenado diretamente
para o coração e SNC, sem passar pelo fígado). Dessa forma, haverá aumento da velocidade de pico sistólico (o pico inicial) e redução / inversão do nadir correspondente à contração atrial.
Na centralização, há aumento da resistência vascular periférica, com aumento da pós-carga cardíaca. Como o coração direito é ligado ao esquerdo (forame oval, por onde passa a maior parte do fluxo do ducto venoso), este aumento da pós-carga influi diretamente no padrão de onda do ducto venoso – assim, quando ocorre a contração atrial, mais sangue será “empurrado” para trás (na contração atrial o forame oval se fecha!), determinando uma onda (que já é invertida normalmente, devido ao fluxo retrogrado) menos ampla e até negativa.
Quando há alteração no fluxo venoso = há perigo ao feto.
Se somente alterações arteriais (umbilical, uterina) = podem ocorrer em fases precoces… sem perigo iminente ao feto ainda.
SEQUENCIA DE ALTERAÇÕES NA INSUFICIÊNCIA PLACENTÁRIA PROGRESSIVA
1. Artéria Umbilical (índices aumentados, fluxo diastólico final ausente ou reverso)
2. Aorta
3. ACM (índices reduzidos, relação entre o IR da umbilical / IR da ACM > 1)
4. Ducto Venoso
5. Pulsação da Veia Umbilical
RESUMO PRÁTICO:
Artérias uterinas (função placentária / utero-placentária):
Avaliação geralmente após 18 semanas de IG.
Em geral, não se avalia após 26 semanas de IG, pois depois disso, quase todas estarão “alteradas”.
Alterado quando:
- A média aritmética entre os dois IPs (de cada artéria uterina)> 1,5
- IR aumentado
- Incisura no inicio da diástole bilateralmente (que pode estar presente de forma não patológica antes de 20 semanas)
- IP > 1,41 a partir do 2o trimestre (no final da gestação pode estar aumentado sem significar alteração)
- Relação pico sistólico / final da diástole > 2,6
- Casos graves: fluxo diastólico zero ou invertido
Descrever no laudo:
- Presença ou ausência de incisura
- IP e IR
- Valores em cada uma das uterina
Artérias umbilicais (função placentária / feto-placentária):
Avaliar sempre, geralmente de 18-20 sem até o termo. No 1o tri, normal fluxo diastólico. Já da metade do 2o tri pra frente (>16sem), é anormal que esteja zero ou reverso. Calcular IP e IR.
Insuficiência placentária quando:
- IP, IR, Sistólica/Diastólica aumentados (> percentil 95)
- Insuficiência placentária grave / gravíssima: diástole zero ou reversa em >16sem (diante destas situações, conduta dependerá de provas de vitalidade e ILA, além de principalmente a análise do ducto venoso)
ACM:
Avaliar a partir do 2o trimestre. Ddeve ser avaliada sempre que o Doppler nas umbilicais estiver alterado. Avaliar IP e IR.
A relação entre o IR da umbilical / IR da ACM não pode ser > do que 1 (ou seja, a resistência da circulação cerebral não pode ser menor do que na umbilical). Quando essa relação estiver alterada, obrigatoriamente deve-se avaliar o ducto venoso.
Ducto venoso:
Altera quando hipoxemia muito intensa. Centralização já não é mais suficiente para manter fluxo sanguíneo às estruturas nobres. Avaliar quando umbilical e/ou ACM alteradas.
O principal é avaliar a forma da onda espectral. A última onda (negativa) se refere à contração atrial (que joga sangue pra trás). Quando essa onda estiver muito próxima da linha de base, zero ou até negativa, quer dizer que está alterado.
Há protocolos que calculam o IP do ducto venoso (nos casos de diástole reversa ou zero, por exemplo, este valor que ditará a conduta): IP<1,0 = conduta conservadora; IP entre 1,0-1,5 = corticosteroide e interromper gestação; IP>1,5 = interromper gestação no dia.
CUIDADO PARA NÃO PEGAR DOPPLER DA VEIA CAVA INFERIOR, QUE TEM NORMALMENTE A ONDA DE CONTRAÇÃO ATRIAL NEGATIVA!
Além disso tudo, na dúvida há valores de referência pra tudo, principalmente para os IRs e IPs das artérias uterinas, umbilicais e da ACM.

BIBLIOGRAFIA:
- Allan PL, Dubbins PA, Pozniak MA, et Clinical Doppler Ultrasound. 3ed. Elsevier. 2014.
- Allon M, Lockhart ME, Lilly RZ, et al. Effect of preoperative sonographic mapping on vascular access outcomes in hemodialysis patients. Kidney Int 2001; 60: 2013-2020.
- Allon M, Robbin ML. Increasing arteriovenous fistulas in patients: problems and solutions. Kidney Int 2002; 62(4): 1109-1124.
- Bakker J, Beutler JJ, Elgersma OEH, et al. Duplex ultrasonography in assessing restenosis of renal artery stenosis. Cardiovasc Intervent Radiol 1999; 22: 475-480.
- Bandyk DF. Essentials of graft surveillance. Semin Vasc Surg 1993; 6:92-102.
- Beathard GA. Strategy for maximizing the use of arteriovenous fistulae. Semin Dial 2000; 13:291–296.
- Brown PWG. Preoperative Radiological Assessment for Vascular Access. Eur J Vasc Endovasc Surg 2006; 31:64-69.
- Carneiro, F. Avaliação do efeito do estímulo manual e audiovisual no estudo de ultrassonografia Doppler do pênis com fármaco-indução em pacientes com difunção erétil. 2019. Tese (Doutorado) – Faculdade de Medicina da Universidade de São Paulo, São Paulo – SP.
- Chagas Neto FA et al. The value of diagnostic imaging in the classification of endoleaks as a complication of endoluminal grafting of aortic aneurysms. Radiol Bras 2010; 43(5): 289-94.
- Chammas MC, Cerri GG. Ultrassonografia abdominal. 2ed. Revinter. 2009.
- Chao A, Daley T, Gruenewald S, et al. Dupplex Ultrasound Critéria for Assessment of Stenosis in Radiocephalic Hemodialysis Fistulas. J Vasc Technology 2001; 25(4): 203-208.
- Clevert DA, Rupp N, Reiser M, et al. Improved diagnosis of vascular dissection by ultrasound B-flow: a comparison with color-coded Doppler and power Doppler sonography. Eur Radiol 2005; 15:342-347.
- Cossman DV, Ellison JE, Wagner WH, et al. Comparison of contrast arteriography to arterial mapping with color-flow duplex imaging in the lower extremities. J Vasc Surg 1989; 10: 522-529.
- Eknovan, G, Levin N. NKF-K/DOQI Clinical Practice Guidelines for Vascular Access: 2000. Am J Kidney Dis 2001; 37:S137-S181.
- Engelhorn CA, Engelhorn AL, Salles Cunha SX, et al. Relantioship betwen reflux and greater saphenous vein diameter. J Vasc Technol 1997; 21(3):167-72.
- Garcıa-Criado A, Gilabert R, Nicolau C, et al. Value of Doppler sonography for predicting clinical outcome after renal artery revascularization in atherosclerotic renal artery stenosis. J Ultrasound Med 2005; 24(12):1641-1647.
- Girndt M, Kaul H, Maute C, et al. Enhanced flow velocity after stenting of renal arteries is associated with decreased renal function. Nephron Clin Pract 2007;105:c84-89.
- Granata A, Fiorini F, Andrulli S, et al. Doppler ultrasound and renal artery stenosis: An overview. Journal of Ultrasound 2009; 12: 133-143.
- Grant EG, Benson CB, Moneta GL, et al. Carotid artery stenosis: grayscale and Doppler US diagnosis Society of Radiologists in Ultrasound Consensus Conference. Ultrasound Q 2003;19(4): 190–198.
- Hermsen K, Chong WK. Ultrasound evaluation of abdominal aortic and iliac aneurysms and mesenteric ischemia. Radiol Clin N Am 2004; 42: 364-381.
- House MK, Dowling RJ, King P, et al. Using Doppler Sonography to Reveal Renal Artery Stenosis: An Evaluation of Optimal Imaging Parameters. AJR Am J Roentgenol 1999;173:761-765.
- Jung DC, Park SY, Lee JY. Penile doppler ultrasonography revisited. Ultrasonography, v. 37, n. 1, p. 16–24, 2018.
- Krumme B. Renal Doppler sonography e Update in clinical nephrology. Nephron Clin Pract 2006; 103:c24-28.
- Labropoulos N, Tiongson J, Pryor L, et al. Definition of venous reflux in lower-extremity veins. J Vasc Surg 2003; 38(4): 793-8.
- Lal BK, Hobson RW 2nd, Tofighi B, et al. Duplex ultrasound velocity criteria for the stented carotid artery. J Vasc Surg 2008;47:63-73.
- Lim HK, Lee WJ, Kim SH, et al. Splanchnic arterial stenosis or occlusion: diagnosis at Doppler US. Radiology 1999;211:405-10.
- Lin EP et al. Lower Extremity Venous Doppler. Ultrasound Clin 2008; 3: 147-158.
- Lockhart ME, Robbin ML. Hemodialysis access ultrasound. Ultrasound Q 2001; 17(3): 157-167.
- Lockhart ME, Robbin ML. Renal vascular imaging. Ultrasound and other modalities. Ultrasound Q 2007; 23:279-292.
- Malovrh M. Non-invasive evaluation of vessels by duplex sonography prior to construction of arteriovenous fistulas for haemodialysis. Nephrol Dial Transplant 1998; 13:125–129.
- Malovrh M. The role of sonography in the planning of arteriovenous fistulas for hemodialysis. Semin Dial 2003; 16(4):229–303.
- Middleton et al. Ultrasound Q. 19:56-70, 2003
- Miller PE, Tolwani A, et al. Predictors of adequacy of arteriovenous fistulas in hemodialysis patients. Kidney Int 1999; 56:275–280.
- Mitchell EL, Moneta GL. Mesenteric duplex scanning. Perspect Vasc Surg Endovasc Ther 2006;18:175-83.
- Mólnar LJ, Vezozzo DCP, Cerri GG. Sarvier 1998.
- Moneta GL, Lee RW, Yeager RA, et al. Mesenteric duplex scanning: a blinded prospective study. J Vasc Surg 1993;17:79-84; discussion 5-6.
- Moneta GL, Yeager RA, Dalman R, et al. Duplex ultrasound criteria for diagnosis of splanchnic artery stenosis or occlusion. J Vasc Surg. 1991;14(4): 511-520.
- Palder SB, Kirkman RL, Whittemore AD, et al. Vascular access for hemodialysis: patency rates and results of revision. Ann Surg 1985; 202:235–239.
- Pellerito JS, Revzin MV, Tsang JC, et al. Doppler sonographic criteria for the diagnosis of inferior mesenteric artery stenosis. J Ultrasound Med 2009;28:641-50.
- Radermacher J, Chavan A, Bleck J, et al. Use of Doppler ultrasonography to predict the outcome of therapy for renal artery stenosis. N Engl J Med 2001; 344: 410-417.
- Revzin MV, Pellerito JS. Ultrasoud Assesment of the Mesenteric Arteries. Ultrasound Clinics 2007;2:15.
- Robbin ML, Chamberlain NE, Lockhart ME, et al. Hemodialysis arteriovenous fistula maturity: US evaluation. Radiology 2002; 225:59-64.
- Robbin ML, Oser RF, Allon M, et al. Hemodialysis access graft stenosis: US detection. Radiology 1998; 208:655-661.
- Rubin Netto V, Ventura CAP. Ultrassonografia com Doppler. In: Wolosker N, Fioranelli A, Zerati AE. Cirurgia Vascular e Endovascular: Abordagem Prática. Rio de Janeiro: Atheneu, 2017. p. 107-131.
- Sato DT, Goff CD, Gregory RT, et al. Endoleak after aortic stent graft repair: diagnosis by color duplex ultrasound scan versus computed tomography scan. J Vasc Surg 1998; 28(4): 657-63.
- Sedlacek M, Teodorescue V, Falk A, et al. Hemodialysis access placement with pre-operative non-invasive vascular mapping: comparison between patients with and without diabetes. Am J Kidney Dis 2001; 38:560-564.
- Silva MB, Hobson RW, Pappas PJ et al. A strategy for increasing use of autogenous hemodialysis access procedures: impact of preoperative noninvasive evaluation. J Vasc Surg 1998; 27(2):307-308.
- Spritzer CE, Arata MA, Freed KS. Isolated pelvic deep venous thrombosis: frequency as detected with MR Imaging. Radiology 2001;219:521–5.
- Strandness Jr. DE, Van Breda A. Vascular diseases: surgical and interventional therapy. New York: Churchill Livingstone, 1994.
- Tahmasebpour HR, Buckley AR, Cooperberg PL, et al. Sonographic Examination of the Carotid Arteries. Radiographics 2005; 25: 1561-1575.
- Teodorescu V, Gustavson S, Schanzer H. Duplex Ultrasound Evaluation of Hemodialysis Access: A Detailed Protocol. International Journal of Nephrology
- Thrush A, Hartshorne T. Peripheral Vascular Ultrasound: How, Why and When. 2ed. Elsevier. 2005.
- Toregeani JF, Kimura CJ, Rocha AST, et al. Avaliação da maturação das fístulas arteriovenosas para hemodiálise pelo eco-Doppler colorido. J Vasc Bras 2008; 7(3): 203-213.
- Van Bemmelen S, Bedford G, Beach K, et al. Quantitative segmental evaluation of venous valvular reflux with dupplex ultrasound scanning. J Vasc Surg 1989;10(4): 425-31.
- Wanhainen A, Bergqvist D, Bjorck M. Measuring the abdominal aorta with ultrasonography and computed tomography: difference and variability. Eur J Vasc Endovasc Surg 2002; 24(5): 428-434.
- White GH, Yu W, Chaufour X, et al. Endoleak as a complication of endoluminal grafting of abdominal aortic aneurysms: classification, incidence, diagnosis, and management. J Endovasc Surg 1997; 4: 152-68.
- Williams GJ, Macaskill P, Chan SF, et al. Comparative Accuracy of Renal Duplex Sonographic Parameters in the Diagnosis of Renal Artery Stenosis: Paired and Unpaired Analysis. AJR Am J Roentgenol 2007; 188(3):798-811.
- Zhou W, Felkai DD, Evans M, et al. Ultrasound criteria for severe in-stent restenosis fllowing carotid artery stenting. J Vasc Surg 2008; 47:74-80.
- Zwiebel WJ, Pellerito J. Introdução à ultra-sonografia vascular. 5ed. Elsevier. 2006.